Билет № 3
Физические методы пробоподготовки.
Наиболее распространенными физическими методами пробоподготовки являются: удаление влаги, измельчение и обработка поверхности.
а) Удаление влаги чаще всего осуществляют путем простого высушивания на воздухе. Однако эта процедура может занят несколько суток, поэтому часто используют высушивание при повышенной температуре. Недостаток этого способа удаления влаги заключается в возможности потерь массы вследствие удаления газообразных веществ и испарения части пробы. Этого недостатка лишено лиофильное высушивание, т.е. высушивание в замороженном состоянии при температурах до -85°С.
б) Измельчение твердых проб осуществляют при помощи мельниц, в которых проба превращается в порошок с определенным размером частиц. Для предотвращения загрязнения пробы детали мельниц изготавливают из твердых инертных материалов.
в) В ряде методов, в которых осуществляется непосредственный анализ твердых образцов, проводят тщательную очистку поверхности проб, поверхность пробы шлифуют или полируют.
Физико-химические и химические методы пробоподготовки.
Эти методы пробоподготовки используют для перевода пробы в физическое состояние, нужное для осуществления анализа по выбранной методике
а) Растворение твердых проб осуществляют с использованием воды, кислот, растворов щелочей или органических растворителей. При анализе почв проводят элюирование (выщелачивание).
б) Разложение (вскрытие) проб проводят при нормальном и повышенном давлении, а также используют «сухое» разложение. В открытых системах для разложения используют жидкие реагенты, обычно окислители или восстановители. Например, разложение проб почв и донных отложений для определения в них металлов можно проводить путем кипячения с царской водкой с обратным холодильником. Поскольку разлагающий реагент берется в большом избытке, к его чистоте предъявляются повышенные требования.
Методы разложения пробы.
Для разложения можно использовать микроволновые печи, излучающие обычно при 2-45 ГГц, или УФ-излучение ртутной лампы высокого давления. В последнем случае к пробе обычно добавляют небольшие количества пероксида водорода и кислот.
Биологические материалы, продукты питания, пластмассы, угли, смазочные масла требуется разлагать в особо жестких условиях. Для этого служат методы разложения при повышенном давлении. В устройстве Кнаппа (рис. 1.8) твердая проба пребывает в течение нескольких часов в автоклаве в атмосфере азота под давлением 13 МПа при температуре до 320°С в контакте с концентрированной азотной кислотой. По окончании процесса и охлаждении пробы в кварцевом сосуде для разложения остается давление порядка 2 МПа. При стравливании избыточного давления из сосуда удаляется азот, диоксид углерода, оксиды азота и остается прозрачный раствор, окрашенный в темно-зеленый цвет за счет остаточных количеств растворенных оксидов азота.
Разложение под давлением можно ускорить, если использовать микроволновые печи. Однако полнота разложения при этом может оказаться ниже.
Помимо применения жидких реагентов, для разложения используют и «сухие» способы, например, сжигание пробы или ее плавление. Для элементного анализа органических веществ пробу можно сжигать в токе кислорода при 950°С. Органические вещества, экстрагируемые пентаном или гексаном, можно полностью сжечь в кислородно-водородном пламени методом Викбольда. При озолении в холодной плазме пробу обрабатывают атомарным кислородом, образующимся в высокочастотном электромагнитном поле. В таком состоянии кислород является особенно сильным окислителем. При определении мышьяка, сурьмы, теллура и селена в органических и биологических пробах можно использовать их способность образовывать легколетучие соединения.
г) Разделение и концентрирование. Как для отделения определяемого компонента от матрицы, так и для его концентрирования можно применять одни и те же способы. Концентрированием называется процесс, в результате которого возрастает концентрация компонента в растворе либо его доля по отношению к матрице по сравнению с исходной пробой.
Важнейшими методами разделения и концентрирования являются:
· отгонка летучих компонентов;
· осаждение или соосаждение компонента на коллекторе;
· экстракция и ионный обмен;
· электролитическое выделение;
· колоночная хроматография и сорбция.
Разделение и концентрирование газовых проб можно осуществить непосредственно в ходе пробоотбора, используя абсорбцию жидкостью (рис. 1.3) или адсорбцию твердой фазой (рис. 1.4). Так, на тенаксе — разновидности активированного угля — хорошо адсорбируются пары спиртов, сложных эфиров, кетонов и ароматических соединений.
Выделение легколетучих органических веществ из водных растворов можно осуществить с помощью следующего приема. Раствор пробы кипятят на водяной бане и продувают потоком газа-носителя (гелий), поступающим на адсорбционную колонку. После термической десорбции адсорбированные компоненты определяют методом газовой хроматографии.
Можно определять легколетучие вещества и непосредственно в паровой фазе. Сосуд с анализируемым раствором плотно закрывают. Через некоторое время между определяемым компонентом, находящимся в растворе, и его парами устанавливается равновесие. С помощью соответствующей градуировки можно установить зависимость между содержанием паров в газовой фазе и концентрацией вещества в растворе. В этом методе определяемый компонент и матрица разделяются сами собой. Такой способ пробоподготовки используют, например, при определении летучих углеводородов в водах или содержания алкоголя в крови.
д) Удаление матрицы можно осуществлять при помощи тех же методов, которые применяют для разделения и концентрировании. На практике наиболее распространен сорбционный метод. Жидкую (или переведенную в раствор) пробу пропускают через стеклянную или пластмассовую колонку, заполненную соответствующим сорбентом; при этом компоненты пробы сорбируются. Мешающие компоненты матрицы затем удаляют путем промывания колонки подходящим элюентом. Затем другим элюентом вымывают из колонки определяемый компонент.
Традиционными методами пробоподготовки являются сухая и мокрая минерализация. Сухая минерализация представляет собой нагревание пробы на воздухе до температуры 450-550С в муфельной печи. Единственным реагентом при сухом озолении является кислород воздуха, при помощи которого происходит окисление органической матрицы. Влажный материал перед озолением высушивают в сушильном шкафу или на плитке, летучие растворители удаляют выпариванием на водяной бане. Чашку с пробой помещают в муфельную печь и постепенно нагревают до нужной температуры. Если остаются черные частицы, то озоление повторяют или вводят окислительные добавки. Золу, получаемую после прокаливания, переводят в раствор с помощью кислот. При сухом озолении возможно улетучивание некоторых элементов. Иногда добавляют вещества, способствующие более эффективному и быстрому окислению и предотвращающие улетучивание некоторых компонентов пробы.
Способ мокрой минерализации основан на полном окислении органических веществ сильными окислителями при температуре 150-2000С. «Мокрые» способы не требуют высоких температур, поэтому не сопряжены с большими потерями летучих веществ; это их преимущество. Недостатки связаны с большими временными затратами и необходимостью введения большого количества реагента-окислителя, что может быть источником загрязнений пробы. Наиболее часто применяются смеси: HNO3 -H2SO4-HClO4; HNO3- HClO4; HClO4- H2SO4; HNO3-H2O2. Можно проводить окисление пероксидом водорода или перманганатом калия. Для разрушения органических веществ, остающихся после обработки смесью серной и азотной кислот, а так же одной из кислот окислителей (серной, азотной, хлорной кислотой и т.п.), добавляют пероксид водорода или перманганат калия. Иногда применяют смесь серной и хромовой кислот, перманганата калия в кислой и щелочной средах и др.. При выборе реагентов необходимо принимать во внимание их чистоту, возможное образование мешающих веществ и пригодность способа минерализации для данного метода определения.
Сплавление и спекание.
Сплавление. Сплавление как метод разложения пробы сухим способом чаще используют при анализе неорганических веществ.
При сплавлении тонко измельченный образец перемешивают с 8—10-кратным избытком реагента (плавня) и нагревают (300—10000C) до получения прозрачного плава. Время плавления определяют опытным путем. После охлаждения застывшую массу растворяют в воде или кислотах.
При сплавлении используют щелочные, кислые, окислительные плавни. В качестве щелочных плавней часто применяют карбонаты, гидроксиды, бораты щелочных металлов и их смеси. При обработке щелочным плавнем металлические компоненты превращаются в растворимые в кислотах оксиды и соли, неметаллические — в растворимые соли щелочных металлов. Из плавней, обладающих кислыми свойствами, чаще используют пиросульфат калия, гидросульфат калия и B2Og. При этом в плаве образуются сульфаты и бораты соответствующих металлов.
В качестве окислительных плавней используют щелочные плавни (Na2COg, Na2B4O?, NaOH и др.) с добавкой окисляющих веществ (KNO3, NaNO3, КСЮз и др.). Наиболее активный окислительный плавень — пероксид натрия Na2O2
Спекание — это взаимодействие веществ при повышенной температуре в твердой фазе.
Прокаливание пробы с подходящим твердым реагентом не всегда сопровождается образованием расплава; в отдельных случаях смесь не расплавляется, а только спекается. Спекание — сложный, полностью не изученный процесс. Предполагается, что спекание основано на высоком химическом сродстве компонентов пробы к введенным реагентам, диффузии и реакциях обмена.
В отдельных случаях спекание позволяет провести разложение пробы быстрее и проще, способствует уменьшению загрязнений, поскольку при этом часто используют меньший (двух- или четырехкратный) избыток реагентов и менее высокие температуры.
Спекание проводят обычно со смесью карбонатов щелочных металлов и оксидов магния, кальция или цинка. Рекомендуется использовать спекание при разложении проб силикатов, сульфидов, оксидов металлов.
Так, при разложении силикатов с целью определения в них щелочных металлов проводят спекание пробы со смесью CaCOs и NH4C1 в соотношении 8:1 (метод Лоуренса—Смита). Сначала при слабом нагревании хлорид аммония сублимируется и диссоциирует с образованием аммиака и хлорида водорода, последний взаимодействует с CaCO3 с образованием мелких частиц CaCl2.
При повышении температуры до 1000—1100° С медленно выделяется CO2, а смесь CaO и CaCl2 взаимодействует с пробой, образуя силикат кальция и хлориды щелочных металлов.
Билет №4
Подготовка проб к анализу в лаборатории
Развитие технологий экоаналитического контроля объектов окружающей среды в настоящее время идет двумя путями: разработка максимально селективных и чувствительных методов определения индивидуальных веществ или сочетание методов предварительной пробоподготовки (разделения и концентрирования) с неселективными методами определения в “комбинированных” методах анализа. Следует заметить, что применение таких комбинированных методов анализа часто позволяет получать необходимый результат, отвечающий всем метрологическим требованиям, более быстро и с меньшими материальными затратами, чем при использовании уникального и весьма дорогого оборудования.
Задачами пробоподготовки, как правило, являются: гомогенизация, обогащение пробы (концентрирование), удаление мешающих примесей.
Гомогенизация проб особенно важна для твердых (сыпучих) образцов проб и реже жидких. Она обеспечивает воспроизводимость анализа и во многом технически облегчает количественный анализ.
Гомогенизацию твердых образцов, как правило, осуществляют путем размола, дробления, измельчения, смешения и т.п. Аналогичные операции применяют для подготовки проб к растворению или химической обработке (модификации), поскольку уменьшение размеров частиц сопровождается увеличением их поверхности и, соответственно, повышением скорости взаимодействия с реагентами.
Концентрирование микропримесей
1) Выпаривание
выпаривание воды из проб – самый простой способ концентрирования и вполне доступный. Так легко можно увеличить концентрации растворенных веществ в 10 – 100 раз.
Однако, существуют недостатки:
- концентрируются не только определяемые в воде микрокомпоненты, но и макрокомпоненты при высоких концентрациях обычно мешают определению,
- нередко происходит выпадение осадков, дальнейшее определение которых фильтрованием может привести к потере определяемых компонентов пробы,
- потери и даже удаление определяемого вещества происходит, если это вещество летуче при температуре выпаривания,
- возможно и загрязнение пробы веществами, извлекаемыми из материала посуды.
Значительно эффективнее выпаривание после экстракции, т. е. выпаривание экстрагента.
Экстракция
Экстракция органических веществ растворителями наиболее распространенный метод концентрирования при анализе вод. Сильная зависимость коэффициентов распределения от характера взаимодействия извлекаемого вещества с экстрагентом и водой позволяет с остаточной мерой вероятности предсказать группу растворителя для извлечения тех или иных органических веществ.
Для группового экстрагирования чаще всего рекомендуют циклогексан, хлороформ, метиленхлорид, диэтиловый эфир.
Экстрагенты должны удовлетворять довольно жестким требованиям:
- экстрагенты должны обладать хорошей способностью извлекать выделяемое вещество или группу веществ,
- экстрагент должен отличаться малой растворимостью в воде и вода, с другой стороны, должна мало растворяться в экстрагенте,
- желательно, чтобы применяемый экстрагент имел достаточно высокую температуру кипения, не ниже 50 оС,
- плотность экстрагента должна как можно больше отличаться от плотности анализируемого раствора,
- экстрагент не должен взаимодействовать с компонентами анализируемого раствора,
- экстрагент должен быть чистым и легко регенерироваться в лабораторных условиях.
Степень экстракционного извлечения (фактор извлечения R) зависит от константы распределения (Р0) этого вещества между органическим растворителем и водой и выражается формулой:
 ,
,
где r – отношение объемов водной и органической фаз (Vводн./Vорг.).
Из этого уравнения следует, что при прочих равных условиях степень извлечения вещества тем больше, чем больше константа распределения и чем меньше отношение объемов.
Если извлечение проводят многократно одинаковыми объемами растворителя, то степень извлечения после m таких обработок выражается формулой
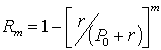 .
.
Для достаточного извлечения требуется многократная обработка, что приводит к получению сильно разбавленного раствора определяемых веществ в органическом растворителе. Последующее выпаривание этого растворителя с целью концентрирования может привести к потере летучих органических веществ. Можно повысить коэффициент распределения в 2 – 5 раз, а следовательно и экстрагента, применяя высаливание, т. е. прибавление больших количеств NaCl и Na2SO4.
Сорбция
Ранее в качестве сорбента использовали исключительно активный уголь. Однако сорбция на нем пригодна не во всех случаях, поскольку часто наблюдаются потери веществ, связанные с неполнотой их сорбции или десорбции, а также изменения в ходе сорбции – десорбции компонентного состава пробы в результате протекания на развитой поверхности активного угля побочных процессов, связанных с содержанием на поверхности каталитически активных металлов.
Возможность синтеза полимерных сорбентов с регулируемыми жесткостью, размером пор и удельной поверхностью привела к тому, что за последние 10 – 15 лет сорбционное концентрирование органических веществ ведут почти исключительно в помощью синтетических полимерных сорбентов и гораздо реже – активного угля или неорганических сорбентов типа силикагелей.
Макросетчатые пористые синтетические сорбенты незначительно набухают в органических растворителях, обладают высокой механической прочностью, химически устойчивы, имеют регулярную структуру, при проведении полимеризации мономеров с различными полярными группами можно придать им различную по химическому действию поверхность.
В аналитической практике применяют сорбенты неполярные (амберлиты ХАД – 1, ХАД – 2 и ХАД – 4), средней полярности (содержащие нейтральные фосфорильные группы амберлиты ХАД – 7 и ХАД – 8) и высокополярные (содержащие амидные группы и нитрозогруппы амберлиты ХАД –11 и ХАД – 12).
Наибольшее распространение получили неполярные сорбенты, при применении которых осуществляется в основном дисперсионные взаимодействия. Причем энергия связи в этом случае ниже энергии связи с поверхностью активного угля, поэтому легче осуществляется десорбция извлеченных веществ.
Мембранные методы.
Мембранный метод – один из наиболее перспективных для концентрирования органических компонентов вод при обработке больших объемов проб.
Преимущества:
- минимум воздействия на состав проб,
- сильная зависимость результатов эксперимента от легко регулируемых факторов (форма ячейки, материал и пористость мембраны, давление, температура), как следствие – высокие коэффициенты концентрирования и при необходимости – фракционирование выделенных веществ по молекулярной массе или другим свойствам.
В качестве материала для полупроницаемых мембран чаще всего используют ацетилцеллюлозу. Описаны также полиамидные, полифурановые, полиакрилонитрильные мембраны, мембраны из полиэтилена различной плотности.
В случае обратноосмотических процессов, идущих при сравнительно высоком давлении, обычно применяют композитные мембраны, обладающие повышенной механической устойчивостью: химически модифицированное пористое стекло, полиуретаны, триацетат или полиамиды на полисульфоне.
Иногда в качестве методов пробоподготовки используют специальную дополнительную обработку проб для модифицирования (получения производных) анализируемого вещества в другое соединение, более легко определяемое выбранным методом анализа.
Для изменения поведения отдельных компонентов проб в процессах разделения рекомендуются различные способы. Можно, например, изменить растворимость вещества, что сказывается на его поведении при извлечении из жидких и твердых проб. Можно изменить полярность молекул путем превращения их в менее полярные производные, что повышает летучесть соединения. В других случаях вводят хромофорные группы или электрофильные группировки для последующего определения методами спектрофотометрии или вольтамперометрии.
В принципе химическую модификацию определяемых соединений можно осуществлять на различных стадиях:
- до выделения компонентов из смеси;
- в процессе выделения (например, непосредственно в хроматографической колонке);
- после выделения вещества из матрицы.
Метод реакционной хроматографии.
Основан на химическом взаимодействии компонентов смеси непосредственно в хроматографической системе, вне ее до или после разделения компонентов анализируемой смеси. Для этого используют такие химические реакции, как гидрирование и дегидрирование, этерификация и гидролиз, образование нелетучих соединений. Реакции проводят в реакционных петлях, включаемых в схему стандартного газового хроматографа. По изменению окраски или выпадению характерного осадка судят о природе примесей, зарегистрированных на хроматографе.
Сверхкритическая флюидная экстракция — процесс экстракции с использованием сверхкритического флюида в качестве растворителя. Производится контактированием смеси разделяемых компонентов с газообразным экстрагентом при температуре и давлении выше критической точки. Наибольшее распространение в качестве экстрагентов (растворителей) получили СО2, этан, этилен, пропан, SF6 и др.
Фильтрационный метод. Твердый носитель смешивают с раствором неподвижной ЖФ, затем суспензию наносят на фильтр, растворитель частично отсасывают, а полученный "мокрый" сорбент затем подсушивают.
Используют и несколько иной вариант фильтрационного метода, когда раствор неподвижной ЖФ наносят на пористый фильтр, добавляют твердый носитель, массу перемешивают в течение нескольких минут, затем фильтруют под вакуумом и высушивают.
Фильтрационный метод целесообразно применять для приготовления сорбентов с низкими концентрациями неподвижной фазы (1-3%). Количество неподвижной ЖФ, оставшейся на твердом носителе, определяется по линейному уравнению
 ,
,
где с н и с p - концентрация неподвижной ЖФ соответственно на носителе и в растворителе, %; а к - коэффициент корреляции.
Метод является достаточно быстрым, однако его существенный недостаток состоит в том, что для определения фактического содержания НЖФ на твердом носителе требуется проведение дополнительных экспериментов. При этом фильтрационный метод используется для приготовления сорбента с различной концентрацией неподвижной жидкой фазы (напр. от 5 до 30%). Затем строится график зависимости концентрации неподвижной ЖФ на твердом носителе от ее концентрации в растворе. Зная последнюю, находят концентрацию неподвижной ЖФ на носителе или наоборот.
Для некоторых носителей существуют таблицы, по которым можно рассчитать требуемую концентрацию раствора, необходимую для нанесения данного процента ЖФ на твердый носитель.
Криогенное концентрирование (улавливание)
Этот прием отбора проб используют в газовой хроматографии при анализе газов и низкокипящих соединений. Он заключается в вымораживании токсичных примесей при пропускании загрязненного воздуха через ловушку с сорбентом или инертным материалом (стекловолокно, стеклянные шарики) при температурах значительно ниже, чем температура кипения анализируемых примесей. Воздух проходит ловушку не удерживаясь. Примеси собираются (конденсируются) в ловушке. Затем ловушку нагревают, и примеси загрязнителей потоком газа-носителя вытесняются в хроматографическую колонку.
Иногда вымораживание сочетают с ИК-спектроскопией, например, концентрируют примеси из воздуха на охлаждаемой жидким азотом пластинке из KBr или NaCI. Затем пластинку помещают в ИК- спектрометр. Особенно эффективен криогенный способ улавливания в газовой хроматографии, позволяющей определять приоритетные
загрязнения воздуха на уровне ppb – ppt.
Степень обогащения пробы определяемыми компонентами может достигать 100-1000 раз и более. Улавливанию мешает влага, она также конденсируется.
Криогенное концентрирование проводят в криогенных ловушках, которые охлаждают с использованием различных охлаждающих смесей. Так, для углеводородов С1-С3, фреонов в качестве хладоагентов используют жидкие воздух (–147ºС) или азот (–185ºС).
Прием вымораживания примесей эффективен в анализе полярных, неустойчивых и реакционно способных соединений. Если в ловушке дополнительно есть сорбент, то глубокого охлаждения не требуется, вполне достаточно использовать «сухой лед» (твердая углекислота).
Недостатком криогенного концентрирования является конденсация в ловушке воды, что уменьшает адсорбционную емкость сорбента. Кроме того, вода может растворять адсорбированные примеси и изменять состав пробы. Влагу предварительно удаляют с использованием различных осушителей.
.