ОКСИДЫ
Все вещества делятся на простые и сложные. Простые, в свою очередь, подразделяются на металлы и неметаллы.
В твердом состоянии большинство веществ имеют кристаллическое строение. Связь в кристаллической решетке металлов – металлическая. Это обуславливает их особые физические свойства: электропроводность, теплопроводность, пластичность. Атомы неметаллов связаны между собой с помощью неполярной ковалентной связи. Они могут иметь атомную (алмаз, графит, кремний) или молекулярную (белый фарфор, галогены, кристаллическая сера S8) кристаллическую решетки. Поэтому физические свойства неметаллов весьма различны.
Сложные вещества делятся на 4 класса: оксиды, основания, кислоты, соли.
Оксидами называются сложные вещества, состоящие из двух химических элементов, один из которых кислород.
Номенклатура оксидов. Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
При составлении формул оксидов необходимо помнить, что молекула всегда электронейтральна, т.е. она содержит одинаковое число положительных и отрицательных зарядов. Степень окисления кислорода в оксидах всегда – 2. Выравнивание зарядов производят индексами, которые ставят внизу справа у элемента.
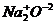
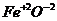


Характерная степени окисления элементов определяется следующим образом:
I группа – в основном +1,
II группа – в основном +2,
III группа – в основном +3,
IV группа – в основном +2, +4 (четные числа),
V группа – в основном +3, +5 (нечетные числа),
VI группа – в основном +2, +4, +6 (четные числа),
VII группа – в основном +3, +5, +7 (нечетные числа).
Классификация оксидов. По химическим свойствам оксиды делятся на две группы:
1) безразличные – не образуют солей, например: NO, CO,
H2O;
2) солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам соответствуют основания. Например, оксиду кальция CaOотвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Получение
1. Непосредственное взаимодействие металла с кислородом:
2Mg + O2  2MgO.
2MgO.
2. Горение сложных веществ:
2FeS + 3O2  2FeO + 2SO2.
2FeO + 2SO2.
3. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
CaO + CO2.
4. Разложение оснований:
Ca(OH)2  CaO + H2O.
CaO + H2O.
Физические свойства
Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого.
Химические свойства
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2  CaSiO3
CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3  Сa (AlO2)2.
Сa (AlO2)2.
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты. Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Получение
1. Горение сложных веществ:
CH4 + 2O2 → CO2 + 2H2O.
2. Разложение кислородосодержащих кислот:
H2SO4  SO3 + H2O.
SO3 + H2O.
3. Взаимодействие неметалла с кислородом:
S + O2  SO2.
SO2.
4. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
CaO + CO2.
Физические свойства
Кислотные оксиды могут быть твердыми, жидкими и газообразными: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный,. SO3 – жидкий. К воде относятся по-разному (Р2О5 – растворимый, SiO2 – нерастворимый).
Химические свойства
1. Взаимодействие с водой с образованием кислоты:
P2O5 + 3H2O → 2H3PO4.
2. Взаимодействие со щелочами с образованием соли и воды:
SO3 + 2NaOH → Na2SO4 + H2O.
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4.
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3,
оксид марганца (IV) MnO2.
Получение
Способы получения амфотерных оксидов аналогичны основным оксидам.
Физические свойства
Поскольку это оксиды металлов, то они, как и основные оксиды, твердые вещества, мало или нерастворимые в воде. (Al2O3 – нерастворим в Н2О). Некоторые из них имеют характерную окраску (Fe2О3 – бурый).
Химические свойства
1. C водой не взаимодействуют.
2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):
ZnO + SiO2 → ZnSiO3.
3. Взаимодействие с кислотами с образованием соли и воды (основные свойства):
ZnO + H2SO4 → ZnSO4 + H2O.
4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4],
AI2O3 + 2NaOH  2NaAIO2 + H2O.
2NaAIO2 + H2O.
5. Взаимодействие с основными оксидами (кислотные свойства):
AI2O3 + CaO  Ca(AIO2)2.
Ca(AIO2)2.
Лабораторная работа № 1
Получение и химические свойства оксидов
Цель работы: ознакомиться с химическими свойствами оксидов и способами их получения. Освоить технику выполнения нагревания в открытом пламени.
Посуда и реактивы: пробирки, пробиркодержатель, спиртовка, фарфоровый тигель, коническая колба, микрошпатель. Набор индикаторов, магниевая лента, кусочки малахита, серы, дистиллированная вода.
Ход работы:
Опыт № 1. Получение и свойства оксида магния
Небольшой кусочек магниевой ленты закрепить в пробиркодержатель и нагреть в пламени спиртовки до начала реакции. Работу надо проводить в темных защитных очках. Отметить, что магний горит ярким пламенем с выделением большого количества тепла. Продукт горения магния собрать в небольшой фарфоровый тигель или пробирку. Отметить цвет порошка. Написать уравнение реакции. Какими свойствами обладает этот порошок?
Полученный порошок растворить в небольшом количестве воды при нагревании. В этот раствор добавить 1–2 капли фенолфталеина. Отметить окраску фенолфталеина и сделать вывод. Напишите уравнения реакций.
Опыт № 2. Получение и свойства оксида меди (II)
В пробирку поместить один микрошпатель карбоната гидроксомеди (II) (CuOH)2CO3 (малахита). Отметить цвет соли. Закрепить пробирку в штативе, осторожно и равномерно прогреть всю пробирку.
Как изменился цвет малахита? Почему на стенках пробирки появились капельки воды? Если закрыть отверстие пробирки пробкой с газоотводной трубкой и опустить в известковую воду, то образуется белый осадок. Написать уравнения реакций. Охладить пробирку до комнатной температуры, прилить небольшое количество воды и осторожно взболтать. Осадку дать отстояться и сделать вывод о его растворимости.
Опыт № 3. Получение и свойства оксида серы (IV)
В термостойкий стакан или коническую колбу налить небольшое количество воды. Нагреть в железной ложке небольшой кусочек серы до воспламенения, опустить ложку в стакан (не касаясь воды) и прикрыть сверху крышкой. Записать уравнения реакции горения серы, учитывая, что образуется оксид серы (1V). Затем убрать ложку, взболтать содержимое стакана и внести в раствор 3–4 капли лакмуса. Как изменится цвет индикатора? Напишите уравнения реакции. Сделайте соответствующие выводы.