Цель работы: установить точную концентрацию раствора Na2S2O3, моль-экв/л.
Сущность работы. Рабочие растворы тиосульфата натрия готовят из перекристаллизованного препарата Na2S2O3 ∙ 5H2O с последующим установлением точной концентрации по иоду, дихромату калия, металлической меди или другому веществу. По точной навеске кристаллического тиосульфата натрия раствор не готовят, так как кристаллогидрат Na2S2O3 ∙ 5H2O выветривается, ионы  разлагаются под влиянием угольной кислоты, растворенной в воде, окисляются кислородом воздуха и т. д.
разлагаются под влиянием угольной кислоты, растворенной в воде, окисляются кислородом воздуха и т. д.
Точную концентрацию раствора тиосульфата натрия устанавливают через 8–10 дней после приготовления. В качестве установочного вещества обычно применяют дихромат калия K2Cr2O7. Он не содержит кристаллизационной воды, растворы его очень устойчивы.
При установке точной концентрации раствора тиосульфата натрия по дихромату калия применяют метод замещения. К определенному количеству раствора дихромата прибавляют избыток вспомогательного раствора иодида калия и кислоту, затем выделившийся I2 оттитровывают тиосульфатом натрия:

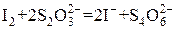
Факторы эквивалентности веществ определяются на основании полуреакций:
 Þ f экв(K2Cr2O7) =
Þ f экв(K2Cr2O7) = 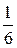
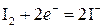 Þ f экв(I2) =
Þ f экв(I2) = 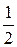
 Þ f экв(Na2S2O3) = 1
Þ f экв(Na2S2O3) = 1
Для фиксирования конечной точки титрования используется специфический индикатор крахмал, образующий с иодом соединение интенсивно синего цвета. Крахмал добавляют вблизи конечной точки титрования, когда основное количество иода уже оттитровано. В противном случае крахмал образует очень прочное соединение с иодом, что приведет к перерасходу тиосульфата натрия.
Оборудование и реактивы: мерная колба, бюретка, пипетка Мора, мерные цилиндры (10–20 мл), коническая колба большой вместимости (250 мл), часовые стекла, 0,05 н. раствор Na2S2O3, 10%-ный раствор KI, кристаллический K2Cr2O7 (х. ч.), 2 н. раствор H2SO4, раствор крахмала.
Выполнение работы. Навеску K2Cr2O7, рассчитанную для приготовления 0,05 н. раствора в мерной колбе определенной вместимости, взвешивают на аналитических весах и переносят в мерную колбу. Растворяют навеску и доводят содержимое колбы до метки дистиллированной водой. Тщательно перемешивают полученный раствор и рассчитывают точную концентрацию K2Cr2O7 в нем (моль-экв/л).
В коническую колбу помещают 10–15 мл KI и 10 мл 2 н. раствора H2SO4. К полученной смеси прибавляют пипеткой аликвотную часть раствора K2Cr2O7 и, накрыв колбу часовым стеклом, чтобы предупредить потери от улетучивания иода, оставляют смесь на 5 мин в темноте. Затем снимают часовое стекло и ополаскивают его над колбой дистиллированной водой.
Прибавляют в колбу еще ~100 мл воды, чтобы раствор сильно разбавился и ионы Cr3+ не мешали фиксированию конечной точки титрования своей собственной серо-синей окраской.
Титруют содержимое колбы стандартным раствором тиосульфата до бледно-желтой окраски, которая указывает на то, что основная часть выделившегося иода уже оттитровалась. Затем прибавляют раствор крахмала до появления интенсивно-синей окраски и продолжают титровать далее до ее исчезновения. Титрование повторяют до получения результатов, отличающихся не более чем на 0,1 мл.
По результатам титрования рассчитывают точную концентрацию раствора тиосульфата натрия, моль-экв/л;
В некоторых случаях по указанию преподавателя раствор Na2S2O3 может быть приготовлен из фиксанала или установление концентрации тиосульфата натрия может быть проведено по приготовленному из фиксанала раствору K2Cr2O7.
| & | М (K2Cr2O7) = 294,185 г/моль |
| : | С использованием ПО «Практикум по АХ и ФХМА »: – оценить неопределенность измерений; – провести Q -тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |