В сернокислом растворе реакция окисления

протекает быстро и количественно.  вводят для обесцвечивания раствора
вводят для обесцвечивания раствора 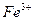 , имеющего желтую окраску и затрудняющего фиксирование конечной точки титрования по окраске перманганата,— образуется бесцветный комплекс
, имеющего желтую окраску и затрудняющего фиксирование конечной точки титрования по окраске перманганата,— образуется бесцветный комплекс  , одновременно улучшаются условия титрования, так как понижается реальный потенциал пары
, одновременно улучшаются условия титрования, так как понижается реальный потенциал пары  .
.
Ход работы:
1. Аликвотную часть исследуемого раствора соли железа (II) переносят пипеткой в коническую колбу, прибавляют 10 см3 раствора  и 2—3 см3 раствора
и 2—3 см3 раствора  (в отсутствие
(в отсутствие  ).
).
Холодный раствор медленно, при тщательном перемешивании титруют раствором  до появления не исчезающей в течение 1 мин розовой окраски. Титрование повторяют не менее 3 раз. Результаты заносят в таблицу 5.2:
до появления не исчезающей в течение 1 мин розовой окраски. Титрование повторяют не менее 3 раз. Результаты заносят в таблицу 5.2:
Результаты титрования раствора железа (II) перманганатом калия.
Таблица 5.2.
| № п/п | V(KMnO4), см3 | С(1/5KMnO4), моль/дм3 | V(Fe(II), см3 | С(1/1 Fe(II), моль/дм3 | Т(1/1 Fe(II), г/см3 |
2. Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание железа (II), учитывая что в точке эквивалентности  . Содержание
. Содержание 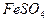 (в
(в  ) вычисляют по формулам:
) вычисляют по формулам:


где  ,
,  — вместимость колбы и пипетки соответственно.
— вместимость колбы и пипетки соответственно.
Определение кальция
Ионы  определяют косвенно. Для этого ионы
определяют косвенно. Для этого ионы  осаждают раствором оксалата аммония, взятом в избытке:
осаждают раствором оксалата аммония, взятом в избытке:

Осадок отфильтровывают, промывают дистиллированной водой и затем растворяют на фильтре в разбавленной серной кислоте (ПР  ПР
ПР 
 ), при этом образуется эквивалентное количество щавелевой кислоты, которую титруют стандартным раствором перманганата калия:
), при этом образуется эквивалентное количество щавелевой кислоты, которую титруют стандартным раствором перманганата калия:

Ход работы:
1. Исследуемый раствор, содержащий  , в мерной колбе разбавляют дистиллированной водой до метки и тщательно перемешивают.
, в мерной колбе разбавляют дистиллированной водой до метки и тщательно перемешивают.
2. Аликвотную часть анализируемого раствора переносят пипеткой в химический стакан вместимостью 200—250 см3, добавляют 100 см3 дистиллированной воды, 1—2 см3 раствора 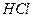 , 1—2 капли индикатора метилового оранжевого и нагревают до 70—80°С.
, 1—2 капли индикатора метилового оранжевого и нагревают до 70—80°С.
3. Медленно, по каплям (1—2 капли в 1 секунду), при непрерывном перемешивании добавляют 1,5-кратный избыток нагретого раствора оксалата аммония.
4. После добавления раствора осадителя прибавляют по каплям при перемешивании разбавленный раствор аммиака до исчезновения розовой окраски раствора и оставляют раствор с осадком на 1 часа на кипящей водяной бане для созревания осадка. Параллельно проводят осаждение не менее трех проб.
5. Созревший осадок оксалата кальция количественно переносят на плотный фильтр и тщательно промывают несколько раз небольшими порциями разбавленного раствора оксалата аммония для удаления ионов  . Признаком конца промывания может служить отсутствие белого осадка при действии на порцию (2—3 капли) промывных вод, подкисленную
. Признаком конца промывания может служить отсутствие белого осадка при действии на порцию (2—3 капли) промывных вод, подкисленную  , раствором
, раствором  .
.
6. Затем промывают осадок дистиллированной водой для удаления избытка оксалат-ионов (отсутствие белого осадка при действии раствора  на 2—3 капли промывных вод). Большого избытка промывных вод следует избегать, так как это может вызвать заметные потери за счет растворения осадка оксалата кальция.
на 2—3 капли промывных вод). Большого избытка промывных вод следует избегать, так как это может вызвать заметные потери за счет растворения осадка оксалата кальция.
7. Бумажный фильтр прокалывают в центре острием стеклянной палочки, которую обмывают над фильтром серной кислотой, и тщательно промывают его 40—50 см3 раствора  и 2 раза дистиллированной водой порциями по 10 см3.
и 2 раза дистиллированной водой порциями по 10 см3.
Полученный раствор  нагревают на водяной бане до 70— 80°С и титруют стандартным раствором
нагревают на водяной бане до 70— 80°С и титруют стандартным раствором  до появления бледно-розовой окраски, не исчезающей 1 минуту. Результаты заносят в таблицу 5.3:
до появления бледно-розовой окраски, не исчезающей 1 минуту. Результаты заносят в таблицу 5.3:
Результаты титрования раствора щавелевой кислоты
раствором перманганата калия.
Таблица 5.3.
| № п/п | V(Н2С2О 4), см3 | С(1/2Н2С2О4), моль/дм3 | V(KMnO4), см3 | С(1/5KМnO4), моль/дм3 | Т(KMnO4), г/см3 |
8. Расчет содержания  проводят с учетом того, что их содержание эквивалентно содержанию оксалат-ионов. В точке эквивалентности
проводят с учетом того, что их содержание эквивалентно содержанию оксалат-ионов. В точке эквивалентности


Содержание  (в г) рассчитывают по формулам:
(в г) рассчитывают по формулам:


Вопросы для самоподготовки.
1. Чем определяется величина скачка на кривой титрования? Приведите примеры приёмов увеличения скачка титрования.
2. В каких случаях кривая титрования симметрична, а в каких — асимметрична относительно точки эквивалентности? Приведите примеры.
3. Каковы особенности приготовления стандартного раствора  и условия его хранения?
и условия его хранения?
4. Какими химическими реакциями, протекающими в растворе, обуславливается изменение концентрации перманганата калия?
5. Почему фактор эквивалентности  различен при проведении реакций в кислой, щелочной или нейтральной средах? Рассчитайте его значение в этих средах.
различен при проведении реакций в кислой, щелочной или нейтральной средах? Рассчитайте его значение в этих средах.
6. Какие вещества применяют для установки характеристик раствора  ? Какие требования к ним предъявляют?
? Какие требования к ним предъявляют?
7. Назовите первичные стандарты, применяемые для установления концентрации перманганата калия.
8. Напишите уравнение реакции взаимодействия перманганат-иона с оксалат-ионом.
9. Как определить перманганатометрическим методом вещества, не обладающие окислительно-восстановительными свойствами, например  ?
?
10. Как определить окислители перманганатометрическим методом:  ?
?
11. Назовите окислители и восстановители, применяемые для предварительного окисления и восстановления титруемых веществ.
12. Какие восстановители применяют для предварительного восстановления железа (III)? Напишите реакции.
13. Объясните роль защитных смесей при титровании железа (II) перманганатом калия в присутствии хлорид-иона.
14. Назовите компоненты смеси Рейнгарда-Циммермана и объясните их роль в процессе титрования железа (II).
15. В каких условиях проводят определение ионов  при отсутствии хлорид-ионов перманганатометрическим методом?
при отсутствии хлорид-ионов перманганатометрическим методом?
16. Вычислите молярную концентрацию эквивалентов раствора  с Т= 0,005815 г/см3 при использовании его в качестве титра в кислой и нейтральной средах.
с Т= 0,005815 г/см3 при использовании его в качестве титра в кислой и нейтральной средах.
17. В мерной колбе вместимостью 100 см3 приготовлен раствор, содержащий 0,6384 г  . Какой объём 0,09349
. Какой объём 0,09349  раствора
раствора  будет израсходован на титрование 10,00 см3 раствора оксалата натрия? Рассчитайте константу равновесия окислительно-восстановительной реакции, пользуясь таблицей окислительно-восстановительных потенциалов.
будет израсходован на титрование 10,00 см3 раствора оксалата натрия? Рассчитайте константу равновесия окислительно-восстановительной реакции, пользуясь таблицей окислительно-восстановительных потенциалов.
18. На титрование раствора  израсходовано 17,25 см3 раствора
израсходовано 17,25 см3 раствора  с
с  . Сколько граммов железа содержится в пробе?
. Сколько граммов железа содержится в пробе?
Иодометрия
Цель и задачи работы.
Закрепление знаний теории окислительно-восстановительного равновесия и титриметрического анализа с применением окислительно-восстановительных реакций. Получение навыков титрования и проведения расчетов результатов анализа и их обработки. Контрольная задача – определение окислителей в растворах неизвестной концентрации.
Оборудование и реактивы:
1. Бюретка вместимостью 25 см3;
2. Мерные колбы вместимостью 00, 250 и 500 см3 ;
3. Колбы для титрования вместимостью 250 см3 ;
4. Пипетки Мора на 5, 10, 15, 25 см3;
5. Аналитические весы с разновесами;
6. Набор ареометров;
7. Бихромат калия  , х.ч. или ч.д.а.;
, х.ч. или ч.д.а.;
8. Тиосульфат натрия  , х.ч. или ч.д.а.;
, х.ч. или ч.д.а.;
9. Иодид калия  , х.ч. или ч.д.а.;
, х.ч. или ч.д.а.;
10. Серная кислота, раствор  = 2 моль/дм3;
= 2 моль/дм3;
11. Сульфат меди (II), раствор  = 0,5 моль/дм3;
= 0,5 моль/дм3;
12. Крахмал, водный раствор.
Программа работы
Определение меди (II)
6.2.1.1. Приготовление первичного стандарта бихромата калия С(1/6K2Сr2О7) = 0,05 моль/дм3
Выполняют по п. 4.2.1.1. из реактива  квалификации х.ч учитывая, что ¦ экв.
квалификации х.ч учитывая, что ¦ экв.  .
.
6.2.1.2. Приготовление рабочего раствора тиосульфата натрия С(1/1Na2S2О3) = 0,05 моль/дм3(вторичного стандарта)
Выполняют по п. 4.2.1.1. из реактива  квалификации х.ч учитывая, что ¦ экв.
квалификации х.ч учитывая, что ¦ экв.  . Для приготовления растворов рекомендуется свежепрокипяченная (в течение часа) вода, так как бактерии разлагают растворы тиосульфата. Для подавления роста бактерий можно добавлять такие вещества, как хлороформ, бензоат натрия или
. Для приготовления растворов рекомендуется свежепрокипяченная (в течение часа) вода, так как бактерии разлагают растворы тиосульфата. Для подавления роста бактерий можно добавлять такие вещества, как хлороформ, бензоат натрия или  . Кипячение воды и добавление небольших количеств (0,1 г/ дм3)
. Кипячение воды и добавление небольших количеств (0,1 г/ дм3)  способствует удалению
способствует удалению  , влияющего на характеристики раствора. Раствор хранят в темном месте в хорошо закрытой посуде. Стандартизацию раствора
, влияющего на характеристики раствора. Раствор хранят в темном месте в хорошо закрытой посуде. Стандартизацию раствора  проводят обычно через 5—7 дней.
проводят обычно через 5—7 дней.