1. Включают магнитную мешалку.
2. Прибавляют по каплям раствор хлорида олова до скачка потенциала, а затем избыток 5 капель.
3. Проводят грубое и точное титрование полученного раствора стандартным раствором бихромата калия по пункту 12.2.1.4 до получения двух последовательных скачков потенциала. Результаты заносят в таблицу 12.2.
4. Титрование повторяют не менее 3 раз.
5. Строят кривые титрования в координатах  и
и  .
.
6. Рассчитывают содержание железа (III) в анализируемом растворе в граммах по формуле:
 ,
,
где 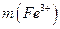 - содержание железа (III) в граммах;
- содержание железа (III) в граммах;
 - объем бихромата калия, пошедший на титрование олова (II), см3;
- объем бихромата калия, пошедший на титрование олова (II), см3;
 - объем бихромата калия, пошедший на титрование олова (II) и
- объем бихромата калия, пошедший на титрование олова (II) и
железа(II), см3;
 – молярная концентрация эквивалентов
– молярная концентрация эквивалентов
бихромата калия, моль/дм3;
 – объем колбы, см3,
– объем колбы, см3,
 – объем аликвоты, см3.
– объем аликвоты, см3.
Ионометрическое определение нитрат-иона в водном растворе.
Прямая потенциометрия основана на измерении электродного потенциала (э.д.с. гальванического элемента), по которому можно определить концентрацию (или активность) потенциалопределяющего иона в растворе после калибровки электрода, используя растворы с известной концентрацией.
Приборы и реактивы
1. Иономер универсальный ЭВ – 74.
2. Измерительный NO3- – селективный электрод ЭМ-NO3-01.
3. Хлорсеребряный электрод.
4. Мерные колбы вместимостью 100 см3 - 5 шт.
5. Пипетка вместимостью 10 см3.
6. Химический стакан вместимостью 50 см3.
7. Нитрат калия, раствор С(1/1KNO3) = 1 моль/дм3.
Ход работы
Приготовление стандартных растворов нитрата калия
1. Нумеруют 5 мерных колб.
2. Отбирают пипеткой 10 см3 раствора нитрата калия  = 1 моль/дм3, переносят в мерную колбу, доводят до метки дистиллированной водой и перемешивают (раствор 1).
= 1 моль/дм3, переносят в мерную колбу, доводят до метки дистиллированной водой и перемешивают (раствор 1).
3. Отбирают 10 см3 раствора 1, переносят в колбу 2 и также доводят до метки водой (раствор 2).
4. Продолжая последовательное разбавление растворов получают стандартные растворы, имеющие 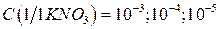 моль/дм3 (растворы 3-5).
моль/дм3 (растворы 3-5).
Подготовка иономера к работе
1.  -– селективный электрод предварительно выдерживают в растворе нитрата калия С(1/1KNO3) = 0,01 моль/дм3 и хранят в нем.
-– селективный электрод предварительно выдерживают в растворе нитрата калия С(1/1KNO3) = 0,01 моль/дм3 и хранят в нем.
2. Измерительный  – селективный электрод включают в гнездо «Изм.» на задней стенке прибора с помощью штуцера.
– селективный электрод включают в гнездо «Изм.» на задней стенке прибора с помощью штуцера.
3. Вспомогательный хлорсеребряный электрод включают в гнездо «Всп.».
4. Включают прибор в сеть и нажимают клавиши «t» и «-1 – 19».
5. Прогревают прибор 20-30 мин.
Построение градуировочного графика
1. Начинают измерения с наиболее разбавленного раствора нитрата калия C(1/1KNO3) = 10-5 моль/дм3 (колба 5). Переносят пипеткой 20 см3 раствора из колбы 5 в стакан для измерений.
2. Электроды промывают дистиллированной водой, высушивают фильтровальной бумагой и погружают в испытуемый раствор.
3. Нажимают кнопки "mV" и «-1-19». Находят значение потенциала грубо по шкале «-1-19», затем точно, выбрав одну из точных шкал.
4. Аналогично находят значение потенциала для растворов 4,3,2 и 1.
5. Строят график в координатах  для пяти растворов.
для пяти растворов.
6. Результаты заносят в таблицу 12.3.
Данные для построения градуировочного графика.
Таблица 12.3.
| № раствора | Концентрация  , моль/л , моль/л
| 
| Потенциал Е, mV |