Решение:
Нитрат свинца (II) Pb(NO3)2 – соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb2+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb2+ + H2O  PbOH+ + H+
PbOH+ + H+
полное ионно-молекулярное уравнение:
Pb2+ + 2NO3- + H2O  PbOH+ + 2NO3– + H+
PbOH+ + 2NO3– + H+
молекулярное уравнение:
Pb(NO3)2+ H2O  PbOHNO3 + HNO3
PbOHNO3 + HNO3
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Карбонат калия K2CO3 – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты CO32– связывают ионы водорода из воды, образуя анионы кислой соли HCO3-. Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO32– + H2O  HCO3– + OH–
HCO3– + OH–
полное ионно-молекулярное уравнение:
2K+ + CO32– + H2O  K+ + HCO3– + K++OH–
K+ + HCO3– + K++OH–
молекулярное уравнение:
K2CO3 + H2O  KHCO3 + KOH
KHCO3 + KOH
Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2 – соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH+.
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn2+ + H2O  ZnOH+ + H+
ZnOH+ + H+
полное ионно-молекулярное уравнение:
Zn2+ + 2Cl- + H2O 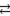 ZnOH+ + 2Cl- + H+
ZnOH+ + 2Cl- + H+
молекулярное уравнение:
ZnCl2+ 2H2O  ZnOHCl+ HCl
ZnOHCl+ HCl
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Сульфит натрия Na2SO3 – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты SO32– связывают ионы водорода из воды, образуя анионы кислой соли HSO3-. Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO32– + H2O  HSO3– + OH–
HSO3– + OH–
полное ионно-молекулярное уравнение:
2Na+ + SO32– + H2O  Na+ + HSO3– + Na++OH–
Na+ + HSO3– + Na++OH–
молекулярное уравнение:
Na2SO3 + H2O  NaHSO3 + NaOH
NaHSO3 + NaOH
Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2 – соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH+.
Сокращенное ионно-молекулярное уравнение гидролиза:
Co2+ + H2O  CoOH+ + H+
CoOH+ + H+
полное ионно-молекулярное уравнение:
Co2+ + 2Cl- + H2O  CoOH+ + 2Cl- + H+
CoOH+ + 2Cl- + H+
молекулярное уравнение:
CoCl2+ 2H2O  CoOHCl+ HCl
CoOHCl+ HCl
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Нитрат алюминия Al(NO3)3 – соль слабого трехкислотного основания и сильной кислоты. Катионы слабого основания Al3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
полное ионно-молекулярное уравнение:
Al3+ + 3NO3- + H2O  AlOH2+ + 3NO3– + H+
AlOH2+ + 3NO3– + H+
молекулярное уравнение:
Al(NO3)3+ H2O  AlOH(NO3)2 + HNO3
AlOH(NO3)2 + HNO3
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).