Решение:
Нитрат меди (II) Cu(NO3)2 – соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Cu2+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Cu2+ + H2O  CuOH+ + H+
CuOH+ + H+
полное ионно-молекулярное уравнение:
Cu2+ + 2NO3- + H2O  CuOH+ + 2NO3– + H+
CuOH+ + 2NO3– + H+
молекулярное уравнение:
Cu(NO3)2+ H2O  CuOHNO3 + HNO3
CuOHNO3 + HNO3
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Сульфид калия К2S – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты S2– связывают ионы водорода из воды, образуя анионы кислой соли HS–. Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
S2– + H2O  HS– + OH–
HS– + OH–
полное ионно-молекулярное уравнение:
2К+ + S2– + H2O  К+ + HS– + К++OH–
К+ + HS– + К++OH–
молекулярное уравнение:
К2S + H2O  КHS + КOH
КHS + КOH
Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7).
22. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
Решение:
Сульфат алюминия Al2(SO4)3 – соль слабого трехкислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли AlOH2+.
Сокращенное ионно-молекулярное уравнение гидролиза:
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
полное ионно-молекулярное уравнение:
2Al3+ + 3SO42- + 2H2O  2AlOH2+ + 3SO42- + 2H+
2AlOH2+ + 3SO42- + 2H+
молекулярное уравнение:
Al2(SO4)3 + 2H2O  2AlOHSO4 + H2SO4
2AlOHSO4 + H2SO4
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Сульфид калия К2S – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты S2– связывают ионы водорода из воды, образуя анионы кислой соли HS–. Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
S2– + H2O  HS– + OH–
HS– + OH–
полное ионно-молекулярное уравнение:
2К+ + S2– + H2O  К+ + HS– + К++OH–
К+ + HS– + К++OH–
молекулярное уравнение:
К2S + H2O  КHS + КOH
КHS + КOH
Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7).
Нитрат свинца (II) Pb(NO3)2 – соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb2+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb2+ + H2O  PbOH+ + H+
PbOH+ + H+
полное ионно-молекулярное уравнение:
Pb2+ + 2NO3- + H2O  PbOH+ + 2NO3– + H+
PbOH+ + 2NO3– + H+
молекулярное уравнение:
Pb(NO3)2+ H2O  PbOHNO3 + HNO3
PbOHNO3 + HNO3
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7).
Хлорид калия KCl - соль сильной кислоты и сильного основания. При растворении в воде хлорид калия диссоциирует на ионы К+ и анионы Cl–. Катионы K+ не могут связывать анионы OH–, так как KOH – сильный электролит. Анионы Cl– не могут связывать катионы Н+, так как НCl – сильный электролит. Таким образом, можно сделать вывод, что хлорид калия не гидролизуется. Равновесие между ионами и молекулами воды не нарушается, и раствор остается нейтральным, рН равен 7.
Как изменится цвет лакмуса в растворах солей: хлорида натрия, карбоната натрия, хлорида меди (II)? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей.
Решение:
Хлорид натрия NaCl - соль сильной кислоты и сильного основания. При растворении в воде хлорид натрия диссоциирует на ионы Na+ и анионы Cl–. Катионы Na+ не могут связывать анионы OH–, так как NaOH – сильный электролит. Анионы Cl– не могут связывать катионы Н+, так как НCl – сильный электролит. Таким образом, можно сделать вывод, что хлорид натрия не гидролизуется. Равновесие между ионами и молекулами воды не нарушается, и раствор остается нейтральным, рН равен 7. Цвет лакмуса не изменяется.
Карбонат натрия Na2CO3 – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты CO32– связывают ионы водорода из воды, образуя анионы кислой соли HCO3-. Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO32– + H2O 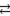 HCO3– + OH–
HCO3– + OH–
полное ионно-молекулярное уравнение:
2Na+ + CO32– + H2O  Na+ + HCO3– + Na++OH–
Na+ + HCO3– + Na++OH–
молекулярное уравнение:
Na2CO3 + H2O  NaHCO3 + NaOH
NaHCO3 + NaOH
Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7). Цвет лакмуса меняется с фиолетового на синий.
Хлорид меди (II) CuCl2 – соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH+.
Сокращенное ионно-молекулярное уравнение гидролиза:
Cu2+ + H2O  CuOH+ + H+
CuOH+ + H+
полное ионно-молекулярное уравнение:
Cu2+ + 2Cl- + H2O  CuOH+ + 2Cl- + H+
CuOH+ + 2Cl- + H+
молекулярное уравнение:
CuCl2+ 2H2O  CuOHCl+ HCl
CuOHCl+ HCl
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH < 7). Цвет лакмуса меняется с фиолетового на красный.