В дальнейшем нам понадобятся понятия моля и молярной массы.
Молем вещества называется такое количество вещества, которое содержит столько же молекул, сколько содержится в 12 г углерода (точнее, в 12 г изотопа углерода С 12). Число молекул в моле любого вещества называется числом Авогадро. Его значение
 .
.
Молярной массой вещества называется масса одного моля этого вещества. Например, молярные массы гелия, водорода, азота и кислорода равны
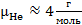 ,
,  ,
, 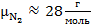 ,
, 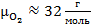 .
.
Ясно, что произведение массы одной молекулы на число Авогадро есть молярная масса:  .
.
Связь между давлением, концентрацией и температурой для идеального газа можно получить, исключив  из равенств (1.1) и (1.2):
из равенств (1.1) и (1.2):
 . (2.1)
. (2.1)
Поскольку  (N - число молекул в сосуде объемом V), то равенство (2.1) принимает вид:
(N - число молекул в сосуде объемом V), то равенство (2.1) принимает вид:
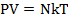 . (2.2)
. (2.2)
Пусть m — масса газа в сосуде, 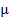 — молярная масса данного газа, тогда
— молярная масса данного газа, тогда  есть число молей газа в сосуде. Число молекул N в сосуде, число молей газа и постоянная Авогадро NA связаны соотношением N = NA: Подставляя это выражение для N в (2.2), получаем:
есть число молей газа в сосуде. Число молекул N в сосуде, число молей газа и постоянная Авогадро NA связаны соотношением N = NA: Подставляя это выражение для N в (2.2), получаем: 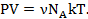 Произведение постоянной Авогадро NA на постоянную Больцмана k называют универсальной газовой постоянной: R = NA ·k
Произведение постоянной Авогадро NA на постоянную Больцмана k называют универсальной газовой постоянной: R = NA ·k  8;31 Дж (моль · K). Таким образом,
8;31 Дж (моль · K). Таким образом,
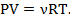 (2.3)
(2.3)
Это уравнение, связывающее давление P, объем V, температуру T (по шкале Кельвина) и число молей идеального газа  , в записи
, в записи
 (2.4)
(2.4)
называется уравнением Менделеева–Клапейрона.
Из равенства (2.4) легко получить зависимость между давлением P, плотностью 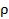 (
( ) и температурой T идеального газа:
) и температурой T идеального газа:
 (2.5)
(2.5)
Каждое из уравнений (2.2), (2.3) и (2.4), связывающих три макроскопических параметра газа P, V и T, называется уравнением состояния идеального газа. Здесь, конечно, речь идет только о газе, находящемся в состоянии термодинамического равновесия, что означает, что все макроскопические параметры не изменяются со временем.
Напомним еще раз, что соотношения (2.1)–(2.5) справедливы только для идеальных газов. Поведение реальных газов при достаточно низких температурах и больших плотностях газов уже плохо описывается моделью идеального газа.
Выразим среднюю квадратичную скорость молекулы идеального газа через температуру T, молярную массу и универсальную газовую постоянную R. Из  и R = NAk следует полезное соотношение:
и R = NAk следует полезное соотношение:
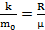 .
.
Тогда из (1.3) получим более практичное выражение:
 . (2.6)
. (2.6)
Пример 2.1. В сосуде объемом 4 л находится 6 г газа под давлением80 кПа. Оценить среднюю квадратичную скорость молекул газа. Газ считать идеальным.
Решение. В задаче  ,
,  ,
,  . Запишем уравнение состояния газа P V = N kT: Если через m 0 обозначим массу молекулы, то
. Запишем уравнение состояния газа P V = N kT: Если через m 0 обозначим массу молекулы, то  ,
,  . Исключая из записанных уравнений N и T, находим среднюю квадратичную скорость:
. Исключая из записанных уравнений N и T, находим среднюю квадратичную скорость:
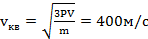 .
.
Заметим, что тот же ответ можно получить из уравнений  и
и 
Равновесные процессы
Если процесс с идеальным газом (или любой термодинамической системой) идет достаточно медленно, то давление и температура газа во всем объеме газа успевают выровняться и принимают в каждый момент времени одинаковые по всему объему значения. Можно сказать, что газ проходит через последовательность равновесных (почти равновесных) состояний. Такой процесс с газом называется равновесным. Другое название равновесного процесса — квазистатический. Все реальные процессы протекают с конечной скоростью и поэтому неравновесны. Но в ряде случаев неравновесностью можно пренебречь. В равновесном процессе в каждый момент времени температура T, давление P и объем V газа имеют вполне определенные значения, т. е. существует зависимость между P и T, V и T, P и V: Это означает, что равновесный процесс можно изображать в виде графиков этих зависимостей. Неравновесный процесс изобразить графически невозможно.
Изопроцессы в газах
Равновесное состояние термодинамической системы характеризуется различными параметрами. Равновесное состояние некоторой массы идеального газа характеризуется тремя параметрами: объемом V, давлением P и температурой T: Эти три параметра связаны уравнением Менделеева–Клапейрона. Изменение одного из параметров вызывает изменение других.
Процесс с термодинамической системой, проходящий при постоянном значении одного из параметров, называется изопроцессом.
Рассмотрим изопроцессы для некоторой массы идеального газа. Построим для изопроцессов графики зависимостей между различными па-
рами параметров из набора V, P, T. Ясно, что таких пар можно составить только три: V и P, V и T, P и T. Для построения графиков понадобится умение строить графики функций  . Все зависимости между двумя парами параметров при фиксированном третьем параметре получаются математическими преобразованиями из уравнения состояния идеального газа.
. Все зависимости между двумя парами параметров при фиксированном третьем параметре получаются математическими преобразованиями из уравнения состояния идеального газа.
1. Изотермический процесс. Процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим. Для нахождения зависимости давления от объема P (V) в изотермическом процессе с некоторой постоянной массой идеального газа (постоянным числом молей 𝜈) запишем уравнение состояния идеального газа в виде
 .
.
Поскольку  = const, T = const, то и
= const, T = const, то и  RT = const. Конечно, все три константы разные. Имеем
RT = const. Конечно, все три константы разные. Имеем
 . (4.1)
. (4.1)
Итак, в изотермическом процессе с идеальным газом графическая зависимость P (V) — гипербола (сплошная кривая на рис. 4.1). Все графики зависимостей между параметрами газа в изотермическом процессе называются изотермами. Изотермы в координатах V, T и P, T приведены на рис. 4.2 и 4.3.
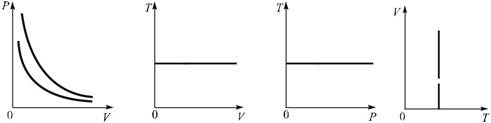
Рис. 4.1. Рис. 4.2. Рис. 4.3. Рис. 4.4.
Разным температурам соответствуют и разные изотермы. Изотерма P (V) для более высокой температуры лежит выше изотермы для более низкой температуры (штриховая кривая на рис. 4.1), что следует из анализа выражения (4.1).
Заметим, что изотерму зависимости между температурой T и объемом V, показанную в осях V, T на рис. 4.2, можно представить в осях T, V, «поменяв» местами расположение осей (рис. 4.4). Изотермы на рис. 4.2 и 4.4 равноправны. Это же относится и к другим изотермам.
На изотермах (рис. 4.2, 4.3, 4.4) есть участки, представленные штриховой линией. Это связано не только с затруднением интерпретации в некоторых случаях нулевых значений параметров идеального газа, но и с тем, что поведение достаточно разреженных реальных газов при не очень низких темпера-турах хорошо описывается моделью идеального газа.
Из (4.1) следует, что для постоянной массы идеального газа при T = const выполняется P V = const: Это закон Бойля–Мариотта.
2. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным (изобарическим). Для идеального газа с постоянной массой (постоянным числом молей  ) зависимость объема V от температуры T (или зависимость температуры от объема) при P = const найдем, записав уравнение состояния идеального газа в виде
) зависимость объема V от температуры T (или зависимость температуры от объема) при P = const найдем, записав уравнение состояния идеального газа в виде
 . (4.2)
. (4.2)
Все графики зависимостей между параметрами газа в изобарном процессе называют изобарами. На рисунках 4.5, 4.6 и 4.7 показаны изобары идеального газа.
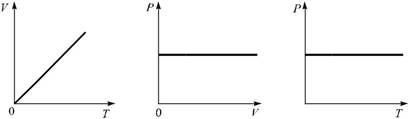
Рис. 4.5. Рис. 4.6. Рис. 4.7.
Зависимость (4.2) для постоянной массы идеального газа при P = const, переписанную в виде  , называют законом Гей–Люссака.
, называют законом Гей–Люссака.
3. Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным (изохорическим). Для идеального газа с постоянной массой (постоянным числом молей 𝜈) зависимость давления P от температуры T (зависимость температуры от давления) при V = const найдем из уравнения состояния идеального газа, записанного в виде
 . (4.3)
. (4.3)
Графики зависимостей между параметрами в изохорном процессе называют изохорами. Изохоры идеального газа показаны на рис. 4.8, 4.9, и 4.10.

Рис. 4.8. Рис. 4.9. Рис. 4.10.
Зависимость (4.3) для постоянной массы идеального газа при V = const, переписанную в виде
 , называют законом Шарля.
, называют законом Шарля.
Пример 4.1. Идеальный газ изотермически расширяют, затем изохорически нагревают и изобарически возвращают в исходное состояние. Нарисовать графики этого равновесного процесса в координатах V, P; T, V; T, P.
Решение. Построим график в координатахV, P.В процессе изотермического расширения из состояния 1 в состояние 2 зависимость давления газа P от объема V имеет вид:  , что следует из уравнения состояния идеального газа. Поскольку температура T постоянна, то
, что следует из уравнения состояния идеального газа. Поскольку температура T постоянна, то  , т. е. изотерма 1–2 является гиперболой (рис. 4.11). В дальнейшем при изохорическом нагревании V = const, и зависимость P от V изображается в координатах V, P отрезком вертикальной прямой 2–3. Изобарический процесс изображается отрезком 3–1 горизонтальной прямой. Графики всего процесса в других координатах строятся аналогично и приведены на рис. 4.12 и 4.13.
, т. е. изотерма 1–2 является гиперболой (рис. 4.11). В дальнейшем при изохорическом нагревании V = const, и зависимость P от V изображается в координатах V, P отрезком вертикальной прямой 2–3. Изобарический процесс изображается отрезком 3–1 горизонтальной прямой. Графики всего процесса в других координатах строятся аналогично и приведены на рис. 4.12 и 4.13.

Рис. 4.11. Рис. 4.12. Рис. 4.13.
Смеси газов
Пусть есть смесь нескольких идеальных газов. Для каждого газа можно записать уравнение  , где
, где  — концентрация молекул i-го газа,
— концентрация молекул i-го газа, 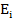 — средняя кинетическая энергия поступательного движения молекул i-го газа, Pi парциальное давление этого газа (давление при мысленном удалении из сосуда молекул других газов). Поскольку давление на стенку сосуда обусловлено ударами о нее всех молекул, то общее давление смеси идеальных газов равно сумме парциальных давлений отдельных газов:
— средняя кинетическая энергия поступательного движения молекул i-го газа, Pi парциальное давление этого газа (давление при мысленном удалении из сосуда молекул других газов). Поскольку давление на стенку сосуда обусловлено ударами о нее всех молекул, то общее давление смеси идеальных газов равно сумме парциальных давлений отдельных газов:
 - закон Дальтона.
- закон Дальтона.
В смеси нескольких идеальных газов уравнения вида (2.1)–(2.5) справедливы для каждого газа в отдельности, причем объем V и температура T у всех газов общие (одинаковые), а парциальные давления отдельных газов и давление в смеси связаны законом Дальтона.
Можно показать, что для смеси идеальных газов давление P, объем V, температура T и суммарное число молей связаны равенством
 ,
,
которое внешне совпадает с равенством (2.3) для одного газа.
Все сказанное для изопроцессов в предыдущем параграфе справедливо и для смеси идеальных газов, поскольку уравнение состояния  для одного газа и смеси записывается одинаково.
для одного газа и смеси записывается одинаково.
Внутренняя энергия
Возьмем макроскопическое тело и перейдем в систему отсчета, связанную с этим телом. В состав внутренней энергии тела входят кинетическая энергия поступательного движения и вращательного движений молекул, энергия колебательного движения атомов в молекулах, потенциальная энергия взаимодействия молекул друг с другом, энергия взаимодействия атомов в каждой молекуле, энергия электронов в атомах, внутриядерная энергия и др.
Будем рассматривать явления, в которых молекулы не изменяют своего строения, а температура еще не так велика, чтобы была необходимость учитывать энергию колебаний атомов в молекуле. При таких явлениях изменение внутренней энергии тела происходит только за счет изменения кинетической энергии молекул и потенциальной энергии их взаимодействия друг с другом. Для общего баланса энергии имеет значение не сама внутренняя энергия, а ее изменение. Поэтому под внутренней энергией макроскопического тела можно подразумевать только сумму кинетической энергии теплового движения всех молекул и потенциальной энергии их взаимодействия.
Внутренняя энергия есть функция состояния тела и определяется макроскопическими параметрами, характеризующими состояние термодинамического равновесия тела.
Потенциальная энергия взаимодействия молекул идеального газа принимается равной нулю. Поэтому внутренняя энергия идеального газа состоит только из кинетической энергии поступательного и вращательного движения молекул и зависит только от температуры. Внутренняя энергия идеального газа от объема газа не зависит, поскольку расстояние между молекулами не влияет на внутреннюю энергию.
Потенциальная энергия взаимодействия молекул реальных газов, жидкостей и твердых тел зависит от расстояния между молекулами. В этом случае внутренняя энергия зависит не только от температуры, но и от объема.
Найдем выражение для внутренней энергии одноатомного идеального газа. Средняя кинетическая энергия одной молекулы этого газа  . В 𝜈 молях содержится 𝜈NA молекул, их энергия
. В 𝜈 молях содержится 𝜈NA молекул, их энергия 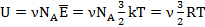 . Итак, внутренняя энергия одноатомного идеального газа
. Итак, внутренняя энергия одноатомного идеального газа
 . (6.1)
. (6.1)
Анализ этой формулы подтверждает высказанное выше утверждение, что внутренняя энергия некоторой массы конкретного идеального газа зависит только от температуры.
Работа в термодинамике
Работа, совершаемая термодинамической системой (телом) над окружающими телами, равна по модулю и противоположна по знаку работе, совершаемой окружающими телами над системой.
При совершении работы часто встречается случай, когда объем тела изменяется. Пусть тело (например, газ) находится под давлением P и при произвольном изменении формы изменяет свой объем на малую величину  . На рис. 7.1 показано увеличение объема воздушного шарика на величину
. На рис. 7.1 показано увеличение объема воздушного шарика на величину  , равную разности конечного и начального объемов шарика.
, равную разности конечного и начального объемов шарика.
Рис. 7.1.
Работа, совершаемая телом над окружающими телами, равна
 .
.
В случае воздушного шарика это работа газа, заключенного внутри шарика, над оболочкой. Здесь P — некоторое среднее давление, можно брать любое значение P за время изменения объема на малую величину  . При положительном
. При положительном  (увеличение объема тела) работа положительна, при
(увеличение объема тела) работа положительна, при 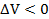 — отрицательна. Вывод этого выражения для работы дан в школьном учебнике для частного случая расширения газа, находящегося в цилиндре под поршнем при постоянном давлении.
— отрицательна. Вывод этого выражения для работы дан в школьном учебнике для частного случая расширения газа, находящегося в цилиндре под поршнем при постоянном давлении.
Любой равновесный процесс, в котором давление будет изменяться по некоторому закону от объема, можно разбить на последовательность элементарных процессов с достаточно малым изменением объема в каждом процессе, вычислить элементарные работы во всех процессах и затем все их сложить.
В результате получится работа тела (газа) в процессе с переменным давлением. В координатах V. P абсолютная величина этой работы равна площади под кривой, изображающей зависимость P от V при переходе из состояния 1 в состояние 2 (рис. 7.2). Математически работа выражается интегралом:
 .
.
В изобарном процессе, когда давление P = const, работа тела над окружающими телами  , где
, где  — изменение объема тела за весь процесс, т. е.
— изменение объема тела за весь процесс, т. е.  уже не обязательно мало.
уже не обязательно мало.
Пример 7.1. Газ переходит из состояния с объемомV 1 и давлениемP 1 в состояние с объемом V 2 и давлением P 2 в процессе, при котором его давление P зависит от объема V линейно (рис. 7.3). Найти работу газа (над окружающими телами).
Решение. Работа газа равна заштрихованной на рис. 7.3 площади трапе-
ции: A =1/2 · (P 1 + P 2)(V 2 -V 1):

Рис. 7.2. Рис. 7.3.