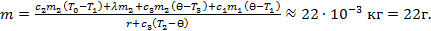Круговым процессом (или циклом) называется термодинамический процесс с телом, в результате совершения которого тело, пройдя через ряд состояний, возвращается в исходное состояние. Если все процессы в цикле равновесные, то цикл считается равновесными. Его можно изобразить графически и получится замкнутая кривая.
На рис. 11.1 показан график зависимости давления P от объема V (диаграмма PV) для некоторого цикла 1–2–3–4–1, совершаемого газом. На участке 4–1–2 газ расширяется и совершает положительную работу A 1, численно равную площади фигуры V 1 412V 2. На участке 2–3–4 газ сжимается и совершает отрицательную работу A 2, модуль которой равен площади фигуры V 2 234V 1: Полная работа газа за цикл A = A 1 + A 2, т. е. положительна и равна площади фигуры 1–2–3–4–1, изображающей цикл на диаграмме PV.
Прямым циклом называется круговой процесс, в котором тело совершает положительную работу за цикл. Прямой равновесный цикл на диаграмме P V изображается замкнутой кривой, которая обходится по часовой стрелке. Пример прямого цикла приведен на рис. 11.1.

Рис. 11.1.
Обратным циклом называется круговой процесс, в котором тело совершает отрицательную работу за цикл. На диаграмме PV замкнутая кривая равновесного обратного цикла обходится против часовой стрелки.
В любом равновесном цикле работа за цикл равна по модулю площади фигуры, ограниченной кривой на диаграмме PV.
В круговом процессе тело возвращается в исходное состояние, т. е. в состояние с первоначальной внутренней энергией. Это значит, что изменение внутренней энергии за цикл равно нулю: 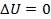 . Так как по первому закону термодинамики для всего цикла
. Так как по первому закону термодинамики для всего цикла  , то Q = A. Итак, алгебраическая сумма всех количеств теплоты, полученной телом за цикл, равна работе тела за цикл.
, то Q = A. Итак, алгебраическая сумма всех количеств теплоты, полученной телом за цикл, равна работе тела за цикл.
На некоторых участках прямого цикла тело получает от окружающих тел количество теплоты Q + (Q + > 0), а на некоторых отдает Q - (Q - > 0), т. е. получает отрицательное количество теплоты (-Q -). За цикл тело совершает положительную работу A. Коэффициентом полезного действия прямого цикла называется величина
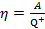 .
.
Поскольку A = Q + + (-Q -), то
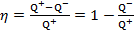 . (11.1)
. (11.1)
Для обратного цикла коэффициент полезного действия не вводится.
Тепловые машины
Пусть есть тело, называемое рабочим телом, которое может совершать цикл (не обязательно равновесный), периодически вступая в тепловой контакт с двумя телами. Тело с более высокой температурой назовем условно нагревателем, а с более низкой температурой – холодильником. За цикл рабочее тело совершает положительную или отрицательную работу A: Такое устройство будем называть тепловой машиной. Тепловая машина, которая служит для получения механической работы, называется тепловым двигателем. Тепловая машина, служащая для передачи количества теплоты от менее нагретого тела (холодильника) к более нагретому (нагревателю), используя работу окружающих тел над рабочим телом, называется тепловым насосом или холодильной установкой (холодильником). Деление на тепловые насосы и холодильные установки условное, связанное с предназначением этих тепловых машин. Тепловой насос используется для поддержания в помещении температуры, которая выше или ниже температуры окружающей среды. Холодильная установка используется для поддержания в некотором объеме (камере) температуры более низкой, чем снаружи. В тепловом двигателе рабочее тело совершает прямой цикл, а в тепловом насосе и холодильной установке — обратный.
В тепловом двигателе рабочее тело получает за цикл (на некоторых участках цикла) от нагревателя количество теплоты Q + (рис. 12.1) и отдает холодильнику положительное количество теплоты Q - (получает от холодильника на других участках цикла отрицательное количество теплоты -Q -). При этом за цикл рабочее тело совершает работу A. Коэффициентом полезного действия (КПД) теплового двигателя называется КПД соответствующего прямого цикла, т. е. отношение совершаемой за цикл работы A к полученному за цикл от нагревателя количеству теплоты Q +:
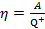 .
.
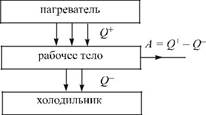
Рис. 12.1.
По первому закону термодинамики, примененному к рабочему телу теплового двигателя за цикл, Q + + (-Q -) = A. Поэтому
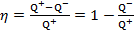 .
.
Видим, что КПД теплового двигателя меньше единицы. Причиной этого является то, что для обеспечения периодичности в работе теплового двигателя необходимо часть теплоты, взятой у нагревателя, обязательно отдать холодильнику.
С. Карно (1796–1832) установил, что максимальный КПД теплового двигателя, работающего с нагревателем температуры T 1 и холодильником температуры T 2, независимо от рабочего тела, есть
 . (12.1)
. (12.1)
Это достигается, если рабочее тело совершает цикл Карно, т. е. равновесный цикл, состоящий из двух адиабат и двух изотерм с температурами T 1 и T 2. На изотерме с T 1 рабочее тело получает тепло от нагревателя, а на изотерме с T 2 — отдает тепло холодильнику. Цикл Карно для идеального газа изображен на рис. 12.2: 1–2 и 3–4 — изотермы, 2–3 и 4–1 — адиабаты. Тепловая машина, работающая по прямому или обратному циклу Карно, называется идеальной тепловой машиной.

Рис. 12.2.
Пример 12.1. Газ, совершающий цикл Карно, отдает холодильнику 60%теплоты, полученной от нагревателя. Температура нагревателя T 1 = 500 K. Найти температуру холодильника.
Решение. Пусть газ получает за цикл от нагревателя количество теплоты Q +. Тогда холодильник получает от газа количество теплоты 0,6Q +:
Применив первый закон термодинамики для всего цикла, получим, что Q + + (-0,6Q +) = A. Отсюда работа за цикл A = 0,4Q +. КПД цикла  .
.
Поскольку для цикла Карно  , то температура холодильника
, то температура холодильника
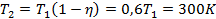 .
.
Пример 12.2. КПД тепловой машины, работающей по циклу (рис. 12.3),состоящему из изотермы 1–2, изохоры 2–3 и адиабатического процесса 3–1, равен  , а разность максимальной и минимальной температур газа в цикле равна
, а разность максимальной и минимальной температур газа в цикле равна 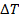 . Найти работу, совершенную 𝜈 молями одноатомного идеального газа в изотермическом процессе.
. Найти работу, совершенную 𝜈 молями одноатомного идеального газа в изотермическом процессе.

Рис. 12.3.
Решение. При решении задач, в которых фигурирует КПД цикла, полезнопредварительно проанализировать все участки цикла, используя первый закон термодинамики, и выявить участки, где рабочее тело получает и где отдает тепло. Это нужно, чтобы получить выражение для Q +.
Предварительно проведем мысленно ряд изотерм на диаграмме PV. Тогда станет ясно, что максимальная температура в цикле будет на изотерме 1–2, а минимальная в точке 3. Поэтому  . Причем в процессе 2–3 температура понижалась, а в процессе 3–1 температура повышалась.
. Причем в процессе 2–3 температура понижалась, а в процессе 3–1 температура повышалась.
Рассмотрим участок 1–2. Для сколь угодно малого участочка, принадлежащего участку 1–2, по первому закону термодинамики 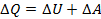 .
. 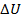 = 0, так как температура постоянна.
= 0, так как температура постоянна.  > 0, так как газ расширяется. Поэтому
> 0, так как газ расширяется. Поэтому  > 0, т. е. газ получает тепло. Итак, на всем участке 1–2 газ непрерывно получает тепло. Поэтому Q12 войдет в Q+.
> 0, т. е. газ получает тепло. Итак, на всем участке 1–2 газ непрерывно получает тепло. Поэтому Q12 войдет в Q+.
Рассмотрим участок 2–3. Проанализируем выражение 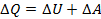 для сколь угодно малого участочка, принадлежащего участку 2–3.
для сколь угодно малого участочка, принадлежащего участку 2–3. 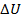 < 0, так как температура уменьшается.
< 0, так как температура уменьшается.  = 0, так как объем не изменяется. Поэтому
= 0, так как объем не изменяется. Поэтому  < 0. Итак, на всем участке 2–3 тепло от газа отводится, т. е. Q23 < 0 и
< 0. Итак, на всем участке 2–3 тепло от газа отводится, т. е. Q23 < 0 и  входит в
входит в 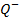 .
.
Рассмотрим участок 3–1. Это адиабата. Газ не получает и не отдает тепло. Итак, газ получает тепло только на участке 1–2, т. е. Q+ = Q12.
Теперь можно приступить непосредственно к решению задачи. По первому закону термодинамики для процесса 1–2 Q12 = (U2 -U1) + A12. Так как U2 -U1=0, то Q12= A12. По первому закону термодинамики для процесса 3-1 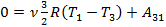 . Так как
. Так как  , то
, то  . За цикл газ совершил работу
. За цикл газ совершил работу
 .
.
КПД машины с учетом, что Q+ = Q12= A12,
 .
.
Отсюда работа в изотермическом процессе 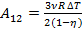 .
.
Фазовые превращения
Состояния, в которых может находиться то или иное вещество, можно разделить на так называемые агрегатные состояния: твердое, жидкое, газообразное. У некоторых веществ нет резкой границы между различными агрегатными состояниями. Например, при нагревании стекла (или другого аморфного вещества) происходит постоянное его размягчение, и невозможно установить момент перехода из твердого состояния в жидкое.
Вещество может переходить из одного состояния в другое. Если при этом изменяется агрегатное состояние вещества или скачком изменяются некоторые характеристики и физические свойства вещества (объем, плотность, теплопроводность, теплоемкость и др.) то говорят, что произошел фазовый переход — вещество перешло из одной фазы в другую. Фазой называется физически однородная часть вещества, отделенная от других частей границей раздела. Пусть в сосуде заключена вода, над которой находится смесь воздуха и водяных паров. Эта система является двухфазной, состоящей из жидкой фазы и газообразной. Можно сделать систему и с двумя различными жидкими фазами: капелька ртути в сосуде с водой. Капельки тумана в воздухе образуют с ним двухфазную систему.
Условия равновесия фаз для многокомпонентных веществ, т. е. веществ, состоящих из однородной смеси нескольких сортов молекул, достаточно сложны. Например, для смеси вода–спирт газообразная и жидкая фазы этой смеси при равновесии имеют различные концентрации своих компонент, зависящие от давления и температуры. Ниже будут рассмотрены фазовые превращения только для однокомпонентных веществ.
При заданном давлении существует вполне определенная температура, при которой две фазы однокомпонентного вещества находятся в равновесии и могут переходить друг в друга при этой температуре. Пока одна фаза полностью не перейдет в другую, температура будет оставаться постоянной, несмотря на подвод или отвод тепла. Поясним это на примерах.
Рассмотрим двухфазную систему вода-пар, находящуюся в замкнутом сосуде. При давлении P 0 = 1 атм  10 5 Па равновесие между паром и водой наступит при 100 0С. Подвод к системе тепла вызывает кипение — переход жидкости в газ при постоянной температуре. Отвод от системы тепла вызывает конденсацию — переход пара в жидкость. При давлении 0,58P 0 (почти вдвое меньше нормального атмосферного) равновесие между паром и водой наступает при 85 0С. При давлении 2P 0 равновесие фаз достигается при температуре
10 5 Па равновесие между паром и водой наступит при 100 0С. Подвод к системе тепла вызывает кипение — переход жидкости в газ при постоянной температуре. Отвод от системы тепла вызывает конденсацию — переход пара в жидкость. При давлении 0,58P 0 (почти вдвое меньше нормального атмосферного) равновесие между паром и водой наступает при 85 0С. При давлении 2P 0 равновесие фаз достигается при температуре  120 0C (такие условия в скороварке).
120 0C (такие условия в скороварке).
Другой пример. Фазовое равновесие между льдом и водой при внешнем давлении P 0 = 1 атм осуществляется, как известно, при 0 0С. Увеличение внешнего давления на одну атмосферу понижает температуру фазового перехода на 0,007 0C. Это значит, что температура плавления льда понизится на эту же незначительную величину.
Фазовые переходы для однокомпонентного вещества, сопровождающиеся переходом из одного агрегатного состояния в другое, идут с поглощением или выделением тепла. К ним относятся плавление и кристаллизация, испарение и конденсация. Причем, если при переходе из одной фазы в другую тепло выделяется, то при обратном переходе поглощается такое же количество теплоты.
Чтобы расплавить кристаллическое тело массой m надо подвести количество теплоты
 . (13.1)
. (13.1)
Коэффициент пропорциональности  называется удельной теплотой плавления. Вообще говоря,
называется удельной теплотой плавления. Вообще говоря,  зависит от той температуры, при которой происходит фазовый переход (температура плавления). Во многих реальных ситуациях этой зависимостью можно пренебречь.
зависит от той температуры, при которой происходит фазовый переход (температура плавления). Во многих реальных ситуациях этой зависимостью можно пренебречь.
Для превращения в пар жидкости массой m надо подвести количество теплоты
 . (13.2)
. (13.2)
Коэффициент пропорциональности r называется удельной теплотой парообразования; он зависит от температуры кипения, т. е. от той температуры, при которой осуществляется фазовое равновесие жидкость-пар для заданного давления.
Значения  и r для разных веществ даются в таблицах обычно для тех температур фазовых переходов, которые соответствуют нормальному атмосферному давлению. При этом в величины и особенно r входит не только изменение внутренней энергии вещества при переходе одной фазы в другую, но и работа этого вещества над внешними телами при фазовом переходе! Например, удельная теплота парообразования воды при 100 0C и P
и r для разных веществ даются в таблицах обычно для тех температур фазовых переходов, которые соответствуют нормальному атмосферному давлению. При этом в величины и особенно r входит не только изменение внутренней энергии вещества при переходе одной фазы в другую, но и работа этого вещества над внешними телами при фазовом переходе! Например, удельная теплота парообразования воды при 100 0C и P  10 5 Па на 9/10 состоит из изменения внутренней энергии вода — пар, на 1/10 (чуть меньше) из работы, которую совершает расширяющийся пар над окружающими телами.
10 5 Па на 9/10 состоит из изменения внутренней энергии вода — пар, на 1/10 (чуть меньше) из работы, которую совершает расширяющийся пар над окружающими телами.
Пример 13.1. В латунном калориметре массойm 1 = 200г находится кусок льда массой m 2 = 100 г при температуре t 1 = -10 0C: Сколько пара, имеющего температуру t 2 = 100 0C, необходимо впустить в калориметр, чтобы образовавшаяся вода имела температуру 40 0C? Удельные теплоемкости латуни, льда и воды  Удельная теплота парообразования воды
Удельная теплота парообразования воды  . Удельная теплота плавления льда
. Удельная теплота плавления льда  .
.
Решение:При конденсации пара массойmпри100 0 C (T 2 = 373K)выделяется количество теплоты Q 1 = r·m. При охлаждении получившейся воды от T 2 = 373 K до Ɵ = 313 K (40 0C) выделяется количество  .
.
При нагревании льда от T 1 = 263 K (-10 0C) до T 0 = 273 K (0 0C) поглощается количество теплоты Q 3 = c 2 m 2 (T 0 -T 1). При плавлении льда поглощается количество теплоты Q 4 = m 2. При нагревании получившейся воды от T 0 до поглощается количество теплоты Q 5 = c 3 m 2 (Ɵ-T 0). Для нагревании калори-метра от T 1 до Ɵ требуется количество теплоты Q 6 = c 1 m 1 (Ɵ-T 1). По закону сохранения энергии Q 1 + Q 2 = Q 3 + Q 4 + Q 5 + Q 6, или
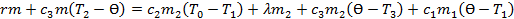 .
.
Отсюда