| Вещество | H0,298, кДж/моль | S0298, Дж/(моль·К) | Теплоемкость Cp, Дж/(моль·К) | |||
| Коэффициенты уравнения Ср= а + bТ + cТ2 | ||||||
| а | в·103 | с·106 | ||||
| CH4(г) | -74,85 | 186,19 | 14,32 | 74,66 | -17,43 | |
| C2H4(г) | 52,30 | 219,45 | 11,32 | 122,01 | -37,90 | |
| C2H6(г) | -84,67 | 229,5 | 5,75 | 175,11 | -57,85 | |
| C3H6(г) | 20,41 | 266,94 | 12,44 | 188,38 | -47,60 | |
| C3H8(г) | -103,90 | 269,91 | 1,72 | 270,75 | -94,48 | |
| н-C4H10(г) | -126,15 | 310,12 | 18,23 | 303,56 | -92,65 |
2. РАСЧЕТ ΔGтº ИЗОБАРНО-ИЗОТЕРМИЧЕСКОГО ПОТЕНЦИАЛА
ХИМИЧЕСКОЙ РЕАКЦИИ
2.1 Расчет ΔGтº по уравнению Гиббса (второй метод)
Исходные данные: ΔНº298, ΔSº298, Cp = а + вТ + С¢Т –2 веществ, участвующих в химической реакции.
Порядок расчёта.
1) Определяем энтальпию реакции при стандартной температуре 298 К.
 (1)
(1)
2) Находим изменение коэффициентов: Δа, Δв, Δс΄,определяющих зависимость Ср = ƒ(Т).
Δа = Σа(продуктов) - Σа(исходных веществ)
Δв = Σв (продуктов) - Σв (исходных веществ)
Δс´ = Σс (продуктов) - Σс (исходных веществ) (2)
3) Находим энтропию химической реакции при 298 К.
 (3)
(3)
4) Определяем теоретическое значение изменения изобарно-изотермического потенциала реакции при температуре Т по уравнению Гиббса:
 (4)
(4)

Для этого находим энтальпию реакции по уравнению
 (5)
(5)

 (6)
(6)
 Подставляя выражения (6) и (5) в (4), получим уравнение, по которому будем вычислять изобарно-изотермический потенциал реакции при температуре Т:
Подставляя выражения (6) и (5) в (4), получим уравнение, по которому будем вычислять изобарно-изотермический потенциал реакции при температуре Т:
 . (7)
. (7)
Рассчитываем значение величины интеграла  .
.
 (8)
(8)
5) Рассчитываем значения величины интеграла  .
.

 (9)
(9)
2.2 Расчет DG0T по уравнению Гиббса-Гельмгольца
(второй метод).
Исходные данные: DH0298, DS0298, Dа, Db, Dс для химической реакции уже вычислены при расчете DG0T по уравнению Гиббса (см. параграф 2.1, формулы 1, 2, 3).
Порядок расчета.
1) Вычисляем изобарно-изотермический потенциал при стандартной температуре 298К.
 . (10)
. (10)
2) Определяем теоретическое значение  по уравнению Гиббса – Гельмгольца
по уравнению Гиббса – Гельмгольца


 (11)
(11)
Для этого преобразуем это уравнение, умножая его на величину Т-2. Получаем
 или
или  .
.
Интегрируя выражение  получаем значение -
получаем значение -  . Умножая это значение на Т получаем
. Умножая это значение на Т получаем 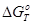 .
.

По уравнению (12) будем рассчитыват ь DG0T реакции для всех значений температуры.
3)Определяем первую константу интегрирования  .
.
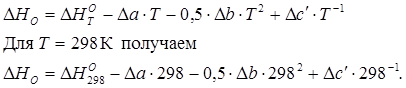 (13)
(13)
2) Определяем вторую константу интегрирования у.
 (14,15)
(14,15)
2.3. Пример расчета DG0T химической реакции
Задание.
 Определить термодинамическую возможность протекания реакции образования MgO•SiO2 при температуре 1200 К.
Определить термодинамическую возможность протекания реакции образования MgO•SiO2 при температуре 1200 К.
Решение.
Уравнение химической реакции:
MgO + SiO2 = MgO•SiO2.
Исходные данные для расчета взять из табл.3.
1. Расчет 
 реакции по уравнению Гиббса (первый метод).
реакции по уравнению Гиббса (первый метод).
Порядок расчета.
1) Определяем энтальпию реакции при 298 К.
DH0298 = DH0298 (MgO•SiO2) - DH0298 (MgO) - DH0298 (SiO2) =
= -1549,87 + 602,11 + 911,58 = -36,18 кДж/моль.
2) Вычисляем изменение коэффициентов зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 102,77 - 42,61 - 46,96 = 13,2.
D b = (19,84 - 7,28 - 34,32)•10-3 = -21,76•10-3.
Dc ´= (-26,08 + 6,20 +11,30)•105 = -8,58•105.
3) Рассчитываем энтропию реакции при 298 К.
DS0298 = S0298 (MgO•SiO2) - S0298 (MgO) - S029 8(SiO2) =
= 67,81 - 26,8-41,86 = -0,85 Дж/(моль•К).
4) Находим значения величин интеграла.
 dT = (13,2•1200 - 0,5•21,76•10-3•12002 + 8,58•105•1200-1) –
dT = (13,2•1200 - 0,5•21,76•10-3•12002 + 8,58•105•1200-1) –
- (13,2•298 - 0,5•21,76•10-3•2982 + 8,58•105•298-1) = - 4958,8 Дж/(моль•К).
5) Находим значения величины интеграла.
 dT = (13,2•ln1200 – 21,76•10-3•1200 + 0,5•8,58•105•1200-2) –
dT = (13,2•ln1200 – 21,76•10-3•1200 + 0,5•8,58•105•1200-2) –
- (13,2•ln298 – 21,76•10-3•298 + 0,5•8,58•105•298-2) = -5,80 Дж/(моль•К).
6) Рассчитываем значение величины изобарно-изотермического потенциала реакции при температуре 1200 К.
DG01200 = -36180,0 - 4958,8 + 1200•0,85 + 1200•5,8 = -33158,8 Дж/(моль•К) =
= -33,2 кДж/(моль•K).
2. Расчет  по уравнению Гиббса-Гельмгольца (второй метод).
по уравнению Гиббса-Гельмгольца (второй метод).
Порядок расчета.
1) Определяем изобарно-изотермический потенциал реакции при 298 К.
DG 0298 = -36180,0 + 298•0,85 = -35926,7 Дж/(моль•К).
2) Вычисляем постоянную интегрирования DH0.
DH 0 = -36180,0 - 13,2•298 + 0,5•21,76•10-3•2982 - 8,58•105•298-1 =
= -42026,6 Дж/моль.
3) Находим постоянную интегрирования у.
у •298 = -35926,7 + 42026,6 + 13,2•298•ln298 - 0,5•21,76•10-3•2982 -
- 0,5•8,58•105•298-1 = 26115,6; у = 87,6.
4) Рассчитываем значение изобарно-изотермического потенциала реакции при 1200 К.
DG01200 = -42026,6 - 13,2•1200•ln1200 + 0,5•21,76•10-3•12002 +
+ 0,5•8,58•105•1200-1 + 87,6•1200 = -33187,5 Дж/моль = -33,2 кДж/моль.
Полученное значение величины изобарно-изотермического потенциала, DG01200 = -33,2 кДж/моль, позволяет сделать заключение о термодинамической вероятности, то есть возможности протекания реакций образования соединения MgO•SiO2 при температуре 1200 К.