Московский Энергетический Институт
(Технический университет)
Кафедра ХИЭЭ
Самостоятельная работа № 5
Тема: электрохимические процессы
Вариант № 24
Студента: Чайкина В.С.
Группы Э-09-10
Преподаватель: Яштулов Н.А
Задача 1. Электродный потенциал и гальванический элемент.
Задание 1
Me - Pb
EpPb2+/Pb=E0Pb2+/Pb+  lnαMe
lnαMe
E0Pb2+/Pb=-0.126 B
EpPb2+/Pb= E0H+/H=0
n=2
αMe=  =18395.6
=18395.6
Задание 2
|
|


 2.1 Pb|PbSO4|| PbSO4|Pb
2.1 Pb|PbSO4|| PbSO4|Pb
|
|
E=Ek-Ea
Рассчитаем равновесный потенциал электрода, находящегося в растворе с концентрацией 0.01 моль/л.
αMe =с=0.01
EpPb2+/Pb=E0Pb2+/Pb+  lnαMe
lnαMe
EpPb2+/Pb=-0.185 B
K(-) Pb|PbSO4|| PbSO4|Pb A(+)
E=0.059 B
Amax= n*F*E=2*96500*0.059 =11387 Дж/моль
2.2 ГЭ K: Pb A: Ni
2.2.1 E0Pb2+/Pb=-0.126 B E0Ni2+/Ni=-0.250B
K: Pb2+ + 2e→Pb
A: Ni→Ni2++2e
ТОР: Ni+ Pb2+→Ni2++ Pb
2.2.2
a)Термодинамический подход
E= - 
∆GТОР=∆Gпрод-∆Gисх=-21,26 кДж
E=0.11B
б)Электрохимический подход
E=Ek-Ea
E=0.12 B
Термодинамический подход точнее, так как в электрохимическом подходе используются значения стандартных потенциалов рассчитанных относительно потенциала водорода, принятого за ноль. В термодинамическом подходе используются конкретные рассчитанные величины энергии Гиббса и числа Фарадея.
2.2.3
При изменении температуры изменяются значения равновесных потенциалов
EpMe=E0Me+  lnαMe при увеличении температуры увеличивается разность потенциалов катода и анода, следовательно увеличивается ЭДС ГЭ.
lnαMe при увеличении температуры увеличивается разность потенциалов катода и анода, следовательно увеличивается ЭДС ГЭ.

|
|

|
|
|


2.2.5 Увеличить напряжение мы можем увеличив ЭДС. Для этого мы можем увеличить температуру, и уменьшить активности ионов обоих электродов. Также можем уменьшить омические потери, уменьшив сопротивление, и уменьшить поляризацию электродов.
U=E-Ir-∆E
Задача 2. Электролиз водных растворов.
Задание 1.
Р-р Cu(NO3)2 электроны С-графит(инертные электроды).
1.1 Cu(NO3)2→Cu2+ + 2NO32-
HOH → H+ + OH-
A: OH-,(NO3-не подвергается электролизу)
K:H+,Cu2+
EpH+/H2=-0.059pH, pH≈5, EpH+/H2=-0.295B
E0Cu2+/Cu=0.337
Разница меньше единицы, поэтому на катоде будут проходить 2 процесса одновременно.
A: 4OH-→O2+2H2O+4e
K: Cu2+ + 2e→ Cu
2H++2e→H2↑
Umin= EpO2/OH- - E0Cu2+/Cu= 0.598
EpO2/OH-=1.23-0.059pH=0.935
E0Cu2+/Cu=0.337
EpH+/H2=-0.295B

1.2 При замене инертных графитовых электродов на медные, состоящие из такого же металла, ионы которого находятся в растворе, мы не вводим в электролизер ионов других металлов, следовательно электродные процессы не изменятся.
Задание 2.
Определите глубину съема металла Al при электрошлифовании его поверхности в водном растворе NaNO3 при анодном выходе металл по току Bj=50%, если за то же самое время выделится водород объемом 0.112л. ρ=2.7 г/см3
1. Определим массу выделившегося металла при электролизе.
m=V*ρ=π*d2/4*h*ρ=1*5*3.14/4*7.14=28г
2. Электродные процессы. Ионный состав.
NaNO3→Na+ + NO3-
HOH → H+ + OH-
K:H+,Na+
A:OH-,Al
pH=7
EpH+/H2=-0.413B
EpO2/OH-=0.817B
E0Al3+/Al=-1.662
E0Na+/Na=-2.714
K: 2H++2e→H2↑
A: Al→Al3++3e
Находим ток по водороду.
 11.2л - 96500 А*с
11.2л - 96500 А*с
q=965 А*с
0.112л - х А*с
q(Al)=0.5*q= 482.5
m=  =
= 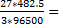 0.045г
0.045г
V= 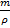 =0.017cm3
=0.017cm3
H= 
d=0.5 cm
H=0.086cm
Ответ: глубина съема металла 0.086см.
Задача 3. Коррозия металлов и защита от коррозии.
3.1/3.2 Сплав Cd-Cu, раствор CuSO4 , c(CuSO4)=0.02  , pпарц(О2)=0.35, pпарц(Н2)=1. Определить возможность коррозии.
, pпарц(О2)=0.35, pпарц(Н2)=1. Определить возможность коррозии.
1)pH среды.

 CuSO4 → Cu2+ + SO4 2-
CuSO4 → Cu2+ + SO4 2-
|
|
Гидролиз происходит по слабой части соли.
Cu2+ + HOH ↔ CuOH+ + H+
CuOH+ + HOH ↔ Cu(OH)2 + H+
Ступенчатая диссоциация слабого основания, раствор имеет сложный молекулярный состав.
КД(Cu(OH)2)2ой стадии = 3,4*10-7
КГ=  = 2,94*10-8
= 2,94*10-8
β=  С(Cu(OH)2)=0.02 CH+=β*C
С(Cu(OH)2)=0.02 CH+=β*C
pH=-lgCH+ = 4.6 Кислая среда.
2) Определение равновесных потенциалов и электрохимических реакций.
EpH+/H2=-0.059*pH=-0.271 B
EpO2/OH-=1,23+0.0147lg(pпарц(О2))=1.22В
E0Cu2+/Cu=0.337B
E0Cd2+/Cd=-0.403B
E0Cu2+/Cu> E0Cd2+/Cd => окисление кадмия.
E0Cu2+/Cu < EpH+/H2 < EpO2/OH- => деполяризация кислорода и водорода.
A: Cd → Cd2++2e
K: O2+4H++4e→2H2O
2H++2e→ H2
3.3
А) Катодное металлическое покрытие: E(катодного покрытия)>E(компонентов сплава)
 E0Cu2+/Cu=0.337B
E0Cu2+/Cu=0.337B
ð Можно использовать серебро как покрытие EAg2+/Ag=0.799
E0Cd2+/Cd=-0.403B
При повреждении покрытия возникнет коррозийный гальванический элемент.
A: Cd → Cd2++2e
K: В зависимости от среды.
Анодное металлическое покрытие: E(анодного покрытия) < E(компонентов сплава)
 |
E0Cu2+/Cu=0.337B
ð Можно использовать литий как покрытие ELi+/Li=-3.045B
E0Cd2+/Cd=-0.403B
При повреждении покрытия сплав – катод коррозионного элемента не корродирует.
A: Li → Li++e
K: В зависимости от среды.
Б) Протекторная защита: Е(протектора) < Е(защищаемого элемента/сплава)
 E0Cu2+/Cu=0.337B
E0Cu2+/Cu=0.337B
ð Можно использовать калий как протектор EК+/К=-2.925
E0Cd2+/Cd=-0.403B
A: К→ К++e
K: В зависимости от среды.