Содержание
I. Общая химия
1. Основные законы химии………………………………………...……………………...3
2. Соотношения между единицами…………………..…………………………………...3
3. Основные понятия химии……………………………….……………………………...4
4. Строение атома…………………..……………………………………………………....5
5. Степень окисления элемента…….……………………………………………………...5
6. Окислители и восстановители…………………….…………………………………...6
7. Метод электронного баланса (алгоритм)………………………………………………6
8. Определение ионов………………………………...…………………………………....7
9. Изменения окраски индикаторов в зависимости от среды…………………………....8
10. Химические свойства классов неорганических веществ………………………….....9
11. Химические свойства металлов……………………………………………………….10
12. Тривиальные названия некоторых неорганических веществ……………………….11
13. Номенклатура некоторых неорганических кислот и солей………………………….12
14. Основные способы получения металлов……………………….……………………..13
15. Гидролиз веществ……………………………………………..………………………..14
II. Органическая химия
1. Общие формулы органических соединений основных классов…….......................…15
2. Алгоритм составления формул изомеров алканов……………..……………………...15
3. Алгоритм составления формул углеводородов по их названию……………………..16
4. Названия некоторых органических веществ…………………………………………...16
5. Качественные реакции органических веществ…………………..…………………..…17
6. Именные реакции в органической химии……………………………………….……..18
7. Важнейшие свойства органических веществ……………………………………….….21
Литература …………………………………………………..………………………………....22
I. Общая химия
Основные законы химии
| Закон | Формулировка |
| Закон сохранения массы | Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции |
| Периодический закон | Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента |
| Закон постоянства состава | Каждое вещество, каким бы способом оно ни было получено, всегда имеет один и тот же качественный и количественный состав |
| Закон сохранения заряда | Число электронов, отданных восстановителю, равно числу электронов, принятых окислителем. |
| Закон Авогадро | В равных объемах различных газов при одинаковых условиях (температура, и давление) содержится одинаковое число молекул |
| Следствие из закона Авогадро | 1. При одинаковых условиях равные количества различных газов занимают равные объемы. 2. При нормальных условиях (Т = 273,15 К, Р = 1,01. 105Па или t = 00C; P = 1атм) 1 моль любого газа занимает объем, примерно равный 22,4л. |
| Объединенный газовый закон |
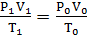 ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у. ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у.
|
Соотношения между единицами
Меры массы
1 т = 103 кг 1 ц = 100 кг 1 кг = 103 г 1 г = 103 мг
Меры объема
1 м3 = 103 дм3 1 м3 = 106 см3 1 дм3 = 103 см3
1 л = 1 дм3 1 м3 = 103 л 1 л = 10-3 м3 1 л = 103см3
Меры длины
1 км = 103 м 1 м = 10 дм 1 м = 100 см
1 дм = 10 см 1 см = 10 мм
Основные понятия химии
| Понятия | Определения | |
| Массовая доля компонента А в системе С |  
| |
| Массовая доля элемента(А) в химическом соединении (АхBy) |

| |
| Массовая доля растворенного вещества в растворе |
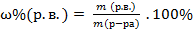
| |
| Массовая доля продукта реакции от теоретически возможного |

| |
| Объемная доля выхода газообразного продукта |

| |
| Объемная доля растворенного вещества в растворе |
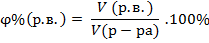
| |
| Молярная (мольная) доля компонента |
 ν (А) число молей компонента А в системе
ν (С) – общее число молей всех компонентов системы
ν (А) число молей компонента А в системе
ν (С) – общее число молей всех компонентов системы
| |
| Относительная плотность | Отношение массы данного объема газа к массе такого же объема другого газа 
| |
| Молярный объем | 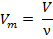
| |
| Молярная масса | 
| |
| Плотность | 
| |
| Число структурных единиц | N = ν . NA; NA= 6, 02. 1023 | |
Строение атома

|
|
|
| ||||||||
= = =
A = N + Z A – относительная атомная масса
N – число нейтронов
Z – порядковый номер элемента (число протонов)
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную относительную атомную массу. (3618 Ar, 3818 Ar, 4018 Ar)
Изобары – разновидности атомов, имеющие одинаковую относительную атомную массу, но разные физические и химические свойства. (4018 Ar, , 4020Ca).
N= 2n2 N – максимальное число электронов на энергетическом уровне.
n- номер энергетического уровня или главное квантовое число.
Степени окисления элемента
Атом0 – е- = катион+ (р+ >e-) (окисляется, восстановитель, окисление)
Атом0 + е- = анион – (p+<e-)(восстанавливается, окислитель, восстановление)
Степень окисления кислорода -2, кроме O+2F2-1, в пероксидах -1 Н2О2-1, Na2O2-1.
Металлы – положительная степень окисления.
Алгоритм определения степени окисления в соединениях
1. Определить степень окисления у наиболее электроотрицательного атома.K2SO42-
2. Определить степень окисления у наименее электроотрицательного атома. K21+SO42-
3. Определить степень окисления у остальных атомов, так чтобы сумма всех степеней окисления была равна нулю. K21+S6+O42 - ; (+1). 2 + х.1 + (-2).4 = 0; х = +6.