1. Алкен обесцвечивает бромную воду
CH2=СH2 + Br2 → CH2Br -СH2Br
Обесцвечивает раствор KMnO4
CH2=СH2 + [O] + Н2О → CH2OH-СH2OH
2. Алкин обесцвечивает бромную воду
CH≡СH + 2Br2 → CH2Br2-СH2Br2
Обесцвечивает раствор KMnO4
CH≡СH + 4[O] + Н2О → HOOC-COOH
3. Реакция на многоатомные спирты
2CH2OH-СH2OH + Cu(OH)2 → 2Н2О + 
Ярко-синий раствор
4. Фенол с бромной водой образует белый осадок

 ОН
ОН
ОН + 3Br2 → Br Br  + 3НBr
+ 3НBr
Br
5. Фенол с хлоридом железа (II) – грязно-фиолетовое окрашивание
6 С6Н5ОН + FeCl3 → [Fe(С6Н5О)6]3- + 3Cl- + 6H+
6. Реакция серебряного зеркала на альдегиды
R-COH + Ag2O → R-COOH + 2Ag
7. Альдегиды с Cu(OH)2
R-COH + Cu(OH)2  R-COOH + Cu2O
R-COOH + Cu2O  + 2Н2О (красный осадок)
+ 2Н2О (красный осадок)
8. Биуретовая реакция с пептидами дает фиолетово-синее окрашивание
(белок с Cu(OH)2).
9. Ксантопротеиновая реакция (белок с азотной концентрированной кислотой дает желтый осадок).
10. Анилин с бромной водой

 NH2
NH2
NH2 + 3Br2 → 3HBr + Br Br 
Br
Именные реакции в органической химии
1. Реакция Вюрца
2СН3-Сl + 2Na  СН3-СH3 + 2NaCl
СН3-СH3 + 2NaCl
2. Реакция Вюрца-Фиттига
С6Н5С1 + 2Na + СН3-Сl  С6Н5СH3 + 2NaCl
С6Н5СH3 + 2NaCl
3. Реакция Коновалова
СН3-СH3 + НО-NО2  СН3-СH2- NО2 + Н2О
СН3-СH2- NО2 + Н2О
4. Реакция Кучерова
СН≡СН + Н2О 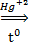 СН3-СOH
СН3-СOH
5. Реакция Фриделя-Крафтса
С6Н6 + С1-СH3  С6Н5СH3 + HCl
С6Н5СH3 + HCl
6. Реакция Зинина
С6Н5NО2 + 6[H]  С6Н5NH2 + 2Н2О
С6Н5NH2 + 2Н2О
7. Реакция Лебедева
2 СН3-СH2-ОН  CH2=CH-CH=СH2 + 2Н2О + Н2
CH2=CH-CH=СH2 + 2Н2О + Н2
n CH2=CH-CH=СH2  (-CH2-CH-=CH-СH2-)n
(-CH2-CH-=CH-СH2-)n
8. Реакция Зелинского – Казанского
3CH≡СН 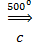 С6Н6 (бензол)
С6Н6 (бензол)
9. Метод Фишера-Тропша
СО2 + 4Н2  СН4 + 2Н2О
СН4 + 2Н2О
CO + 3Н2  СН4 + Н2О
СН4 + Н2О
10. Реакция Кольбе (электролиз солей карбоновых кислот)
2R-COONa + 2Н2О 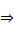 2NaOH + Н2 + R-R + СО2
2NaOH + Н2 + R-R + СО2
11. Реакция Вагнера
CH2=СH2 +  + Н2О → CH2OH-СH2OH
+ Н2О → CH2OH-СH2OH
12. Реакция Гриньяра
СН3-I + Mg  СН3- MgI
СН3- MgI
13. Реакция Канниццаро
С6Н5COH + HCOH  С6Н5CH2OH + HCOONa
С6Н5CH2OH + HCOONa
14. Метод Реймера и Тимана


 OH OH OH
OH OH OH


 +
+
COH
Важнейшие свойства органических соединений.
| Реакции | Классы соединений | ||||||||
| Углеводороды | Производные алканов | ||||||||
| Предельные (алканы) | Непредельные | Арены | Спирты | Альдегиды | Карбоновые кислоты | Амины | Аминокислоты | Эфиры | |
| Окисление | + | + | + | + | + | + | |||
| Горение | + | + | + | + | + | + | + | + | + |
| Восстановление | + | + | + | + | |||||
| Гидрирование (+ водород) | + | + | + | + | |||||
| Дегидрирование (– водород) | + | + | + | ||||||
| Галогенирование (+ галоген) | + | + | + | + | + | ||||
| Гидрогалогенирование (+ галогеноводород) | + | + | + | + | |||||
| Гидратация (+ вода) | + | + | + | + | |||||
| Дегидратация (- вода) | + | ||||||||
| Нитрование (+ нитрогруппа) | + | + | |||||||
| Этерификация (спирт + карб.кислота = сложный эфир) | + | + | + | ||||||
| Гидролиз (разложение веществ водой) | + | ||||||||
| Кислотные свойства | + | + | + | ||||||
| Основные свойства | +* | + | + | ||||||
| Полимеризация (образование полимера) | + | + | |||||||
| Поликонденсация (образование полимера и др. веществ) | +** | + |
*С галогенами
** Для многоатомных спиртов
Литература
1. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса химии: 10-11 классы. М., ВАКО, 2006.
2. Гузей Л.С. Новый справочник по химии. М., Большая Медведица, 2002.
3. Косова О.Ю. ЕГЭ. Химия. Челябинск, Взгляд, 2004.
4. Насонова А.Е. Химия в таблицах. М., Дрофа, 2006.
5. Сорокин В.В. Сборник задач с решениями и ответами. М., Астрель, 2001.
6. Суровцева Р.П. Химия 10-11 классы. Методическое пособие. М., Дрофа, 2001.
7. Тесты. Химия. М., Центр тестирования МО РФ, 2004.
8. Хомченко Г.П. Сборник задач по химии для поступающих в вузы. М., Новая волна, 2003.