4Сr + 3O2 = 2Сr2O3
2Cr + 3Cl2 = 2CrCl3 При нагреваниии
Cr + S = CrS
2Cr + N2 = 2CrN
Cr + 3F2 = CrF6 (взаимодействует даже на холоде)
-В ряду стандартных электродных потенциалов металлов хром стоит до водорода между цинком и железом, молибден также до водорода, но недалеко от него, а вольфрам находится после водорода. Поэтому хром вытесняет водород из разбавленных НСl и Н2SO4.
Взаимодействие с разбавленными растворами НСI и H2SO4
Сr + 2HCl = СrСl2 + Н2↑
Сr + H2SO4 = CrSO4 + Н2↑
-В концентрированных H2SO4 и НNO3 на холоду хром пассивируется. При нагревании хром медленно растворяется в этих кислотах. Соляная кислота и разбавленная Н2SO4 на Мо и W не действуют.
Действие концентрированных HNO3 и H2SO4
Простое вещество Cr БЕЗ НАГРЕВАНИЯ не реагирует с серной и азотной концентрированными кислотами
Сr + 6HNO3(к) = Cr(NO3)3 + 3NO2↑ + 3H2O При нагревании!
2Сr + 6H2SO4(к) = Cr2(SO4)3 + 3SO2↑ + 6H2O При нагревании!
Общим для элементов подгруппы хрома является отсутствие взаимодействия с водородом.
- Вытеснение малоактивных металлов из водных растворов солей
Сr + CuSO4 = CrSO4 + Сu
Сr + Pb(NO3)2 = Cr(NO3)2 + Pb
Соединения Cr (VI) - сильные окислители, переходят в окислительно-восстановительных реакциях в производные Сr(III). Наиболее сильно окислительные свойства Cr(VI) выражены в кислой среде.
К2 Сr2О7 + 6КJ + 7 H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O.
При этом оранжевый цвет раствора бихромата калия сменяется на зеленый или зеленовато-фиолетовый цвет растворов Cr3+.
Соединения Cr (+2) — сильные восстановители, т.к. Хром в минимальной степени окисления.
CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
Соединения Cr (+3) — могут являться и окислителями и восстановителями, т.к. Хром в данных соединениях имеет промежуточную степень окисления.
Сr2O3 + 2Al = 2Сr + Аl2O3
Сr – окислитель
Cr2(SO4)3 + 3Cl2 +16NaOH=2NaCI+6Na2SO4 + 3Na2CrO4 + 8Н2O
Сr2(SO4)з+КСlО3 + 10КОН = 2К2СrO4 + 3К2SО4 + КСl + 5Н2О
Cr – восстановитель
Соединения хрома (+6) — сильные окислители, т.к. Хром находится в максимальной степени окисления.
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2↑ + 2KCl +7Н2О
При обработке кислого раствора хромата или дихромата пероксидом водорода образуется пероксид хрома СrO(O2)2 или СrO5.
Сr2О72- + 4Н2О2 + 2Н+ = 2CrO (O2)2 + 5H2O.
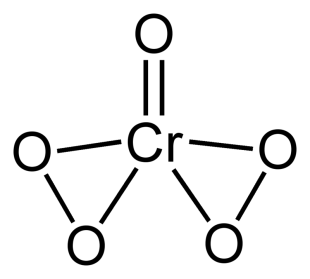 CrO (O2)2 – голубого цвета, в водном растворе нестоек и распадается на кислород и аквакомплексы [Cr(H2O)6]3+.
CrO (O2)2 – голубого цвета, в водном растворе нестоек и распадается на кислород и аквакомплексы [Cr(H2O)6]3+.
Пероксид хрома устойчив в эфире и образует пероксо-комплекс
CrO (O2)2 ∙ L, где L – эфир, пиридин и др. Эти комплексы имеют форму пентагональной пирамиды с атомом кислорода в вершине:
Пероксид хрома в своем составе содержит две пероксидные группы (-О-О-), за счет которых проявляет окислительные свойства.
М  арганец Мn, технеций Тс и рений Rе — элементы-аналоги, образующие группу VIIБ.Из элементов этой группы наиболее распространен в природе марганец. Технеций — радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Рений в земной коре содержится в незначительном количестве. Он относится к редким и рассеянным элементам.Валентные электроны элементов VIIБ-группы [конфигурация (n-1)d5ns2] располагаются на энергетических уровнях следующим образом:
арганец Мn, технеций Тс и рений Rе — элементы-аналоги, образующие группу VIIБ.Из элементов этой группы наиболее распространен в природе марганец. Технеций — радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Рений в земной коре содержится в незначительном количестве. Он относится к редким и рассеянным элементам.Валентные электроны элементов VIIБ-группы [конфигурация (n-1)d5ns2] располагаются на энергетических уровнях следующим образом:
Для марганца характерны степени окисления+2, +3, +4, -1-6, +7. Для остальных элементов этой группы известны только  степени окисления +4 и +7.
степени окисления +4 и +7.
Подобно другим d-элементам, соединения VIIБ-группы в низших степенях окисления проявляют восстановительные свойства, об основных свойствах этих соединений целесообразно говорить только применительно к соединениям марганца, который в растворах существует в виде катионов Мn2+ и Мn3+.
 В высших степенях окисления элементы VIIБ-группы существуют в анионной форме (МnО4-, ТеО4-, RеО4-), проявляя окислительные и кислотные свойства. Для RеO2 преобладают кислотные свойства.
В высших степенях окисления элементы VIIБ-группы существуют в анионной форме (МnО4-, ТеО4-, RеО4-), проявляя окислительные и кислотные свойства. Для RеO2 преобладают кислотные свойства.
В промежуточной степени окисления (IV) явно выраженная амфотерность проявляется у марганца. Это может быть объяснено уменьшением устойчивости элементов с увеличением порядкового номера, что приводит к ослаблению дифференциации кислотно-основных признаков в промежуточных степенях окисления. Поэтому именно у соединений марганца отчетливо прослеживается отмечаемая закономерность изменения кислотно-основных и окислительно-восстановительных свойств.
Реакционная способность элементных веществ VIIБ-группы уменьшается в ряду Мn—Тс—Rе. Без нагревания порошки Мn, Тс и Rе окисляются во влажном воздухе, превращаясь в МnО, ТеО, НRеО4. ионов, а также энергии ионизации (Е Эо → Э+) – обычные для подгруппы. Радиусы частиц сверху вниз в подгруппе незначительно увеличиваются. При этом радиусы атомов и ионов технеция и рения практически одинаковы; энергия ионизации атомов в группе сверху вниз возрастает. Химическая активность в подгруппе марганца сверху вниз с возрастанием атомной массы уменьшается: наиболее активен марганец, а технеций и рений малоактивны и близки между собой по свойствам. В ряду стандартных электродных потенциалов металлов марганец стоит до водорода, а технеций и рений располагаются после водорода.
Марганец – химический элемент с атомным номером 25. Конфигурация двух внешних электронных слоев атома марганца 3s23p63d54s2. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7.
Марганец в компактном виде — твердый серебристо-белый металл. На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления.
Техне́ций (Тс) — первый искусственно полученный радиоактивный химический элемент, атомный номер 43. Технеций не имет стабильных изотопов. Наиболее долгоживущие радиоизотопы: 97Tc (Т1/2 равен 2,6·106 лет, электронный захват), 98Tc (Т1/2равен 1,5·106 лет), 99Tc (Т1/2 равен 2,12·105 лет). Практическое значение имеет короткоживущий ядерный изомер 99mТс (Т 1/2 равен 6,02 часа).
Конфигурация двух внешних электронных слоев 4s2p6d55s2. Cтепени окисления от -1 до +7 (валентности I-VII); наиболее устойчива +7. Рaсположен в группе VIIB в 5 периоде периодической системы элементов. В компактном состоянии имеет серебристо-серый цвет. Технеций — радиоактивный элемент.
Ре́ний (Re) -химический элемент с атомным номером 75, атомная масса 186,207. Встречается в природе в виде двух изотопов: стабильного 185Re (37,4% по массе) и слаборадиоактивного — 187Re (62,6%) (T 1/2 = 5·1010 лет). Конфигурация двух внешних электронных слоев 5 s2p6d5 6 s 2. Рений расположен в группе VIIB периодической системы элементов Менделеева, в 6 периоде. Образует соединения в степенях окисления от –1 до +7 (валентности от I до VII). Наиболее устойчивы соединения в высшей степени окисления (+7).
Получение
1) В металлургии получают марганец восстановлением его оксидов углеродом или кремнием (кремнийтермия).
MnO2 + 2C → Mn + 2CO MnO2 + Si → Mn + SiO2 при нагревании
(Полученный марганец содержит некоторое количество углерода или кремния).
2) Если в качестве исходного сырья применяют смесь пиролюзита с оксидами железа, то при восстановлении углеродом образуется сплав марганца с железом – ферромарганец.
MnO2 + Fe2O3 + 5C → Mn + 2Fe + 5CO при нагревании
3) Чистый марганец получают алюмотермией:
3Mn3O4 + 8Al → 4Al2O3 + 9Mn при нагревании
4) Марганец получают также электролизом водного раствора MnSO4. При этом марганец выделяется на катоде.Ежегодно получают миллионы тонн марганца.
Рений получают восстановлением водородом из перренатов калия или аммония.
2NH4ReO4 + 4H2 → 2Re + N2 + 8H2O при нагревании
2KReO4 + 7H2 → 2KOH + 2Re + 6H2O при нагревании
Ежегодное производство рения измеряется тоннами (рений - очень дорогой металл).
Сейчас время технеций получают либо из отходов переработки ядерного топлива, либо из облученной в циклотроне молибденовой мишени.
Взаимодействие с неметаллами. Марганец легко окисляется кислородом воздуха с образованием оксидов различного состава:
1) При температуре 450 – 800°С получается оксид марганца (III):
4Mn + 3O2 = 2Mn2O3
2) Ниже 450°С образуется оксид марганца (IV):
Mn + O2 = MnO2.
3) С галогенами, кроме фтора, дает галогениды марганца (II):
2Mn + 3F2 = 2MnF3 (MnF4); Mn + Cl2 = MnCl2.
4) При нагревании реагирует с серой, азотом, фосфором, углеродом, кремнием:
Mn + S = MnS;
2Mn + N2 = 2MnN (возможно образование Mn5N2, Mn4N, Mn3N2 и других нитридов);
Mn + P = MnP (возможно образование MnP3, Mn2P, Mn3P, Mn3P2 и других фосфидов);
3Mn + С = Mn3С (возможно образование Mn5С2, Mn15С4, Mn2С7 и других карбидов);
Mn + Si = MnSi (возможно образование Mn3Si, Mn5Si и других силицидов).
Технеций и рений вступают в химическое взаимодействие с неметаллами только при высоких температурах, причем с азотом и йодом не реагируют.
При этом в отличие от марганца они окисляются неметаллами до более высоких степеней окисления:
4Re + 7O2 → 2Re2O7 4Tc + 7O2 → 2Tc2O7 при нагревании
2Re + 7S → Re2S7 Re + 3F2 → ReF6 при нагревании
Взаимодействие с водой. При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью:
Mn + 2H2O = MnO2 + 2H2.
Взаимодействие с кислотами. В электрохимическом ряду напряжений металлов марганец находится до водорода, он вытесняет водород из растворов неокисляющих кислот, при этом образуются соли марганца (II):
Mn + 2HCl = MnCl2 + H2; Mn + H2SO4 = MnSO4 + H2;
1) С разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II):
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
2) Концентрированная азотная и серная кислоты пассивируют марганец. Марганец растворяется в них лишь при нагревании, образуются соли марганца (II) и продукты восстановления кислоты:
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O; Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O.
Так, в отличие от марганца, реагирующего с кислотами, рений реагирует только с азотной и горячей серной кислотами и раствором перекиси водорода.
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O.
Восстановление металлов из оксидов. Марганец – активный металл, способен вытеснять металлы из их оксидов:
5Mn + Nb2O5 = 5MnO + 2Nb.
Оксид марганца (II) МnО встречается в природе в виде мелких зеленых кристаллов, плохо растворимых в воде. При нагревании на воздухе превращается в разные оксиды:
6МnО + 3O2 → 6МnО2 + 3/2 О2 → 3Мn2О3 +4,5 О2 1000°С→ 6МnО3
Оксид марганца (II) растворяется в кислотах:
МnО + 2Н+ + 5Н2О → [Мn(Н2О)6]2+
Обработка аквакомплекса [Мn(Н2О)6]2+ при рН = 8,5 в атмосфере водорода приводит к образованию нерастворимого гидроксида марганца (II):
[Мn(Н2О)6]2+ + 2ОН- → Мn(OH)2↓ + 6Н2О
гидроксид марганца (II) обладает слабоосновными свойствами, окисляется кислородом воздуха и другими окислителями до марганцеватистой кислоты или ее солей манганитов:
Мn(ОН)2 + Н2О2 → Н2МnО3↓ + Н2О
марганцеватистая кислота
(бурый осадок)
В щелочной среде Мn2+ окисляется до МnО42-, а в кислой до МnО4-:
МnSО4 + 2КNО3 + 4КОН → К2МnО4 + 2КNО2 + К2SО4 + 2Н2О
Образуются соли марганцовистой Н2МnО4 и марганцовой НМnО4 кислот.
Оксид марганца (IV) МnО2 является устойчивым природным соединением марганца, которое встречается в четырех модификациях. Все модификации имеют амфотерный характер и обладают окислительно-восстановительной двойственностью.
Примеры окислительно-восстановительной двойственности МnО2:
МnО2 + 2КI + 3СО2 + Н2О → I2 + МnСО3 + 2КНСО3
6МnО2 + 2NH3 → 3Мn2О3 + N2 + 3Н2О
4МnО2 + 3О2 + 4КОН → 4КМnО4 + 2Н2О
Производные Мn(VII) — это оксид марганца (VII) Мn2О7 и его гидратная форма – кислота НМnО4, известная только в растворе. Мn2О7 устойчив до 10°С, разлагается со взрывом:
Мn2О7 → 2МnО2 + О3
При растворении в холодной воде образуется кислота
Мn2O7 + Н2О → 2НМnО4
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой. Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3. Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Наблюдается общая для всех d-элементов закономерность, а именно: в пределах каждой подгруппы (подгруппы железа, кобальта и подгруппы никеля) радиусы атомов сверху вниз увеличиваются, но незначительно. При этом в каждой подгруппе радиусы атомов элементов семейства платиновых металлов (рутения и осмия; родия и иридия; палладия и платины) практически одинаковы. Энергия ионизации (ЕЭ→Э+) в каждой подгруппе сверху вниз возрастает, вследствие чего химическая активность элементов в этом же ряду уменьшается. Восстановительная способность элементов в каждой подгруппе сверху вниз уменьшается: элементы семейства железа (Fe, Co, Ni) в ряду стандартных электродных потенциалов (Ео, в) стоят до водорода, а все элементы семейства платиновых металлов – после водорода.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Химические свойства соединений железа, кобальта, никеля. Оксиды общей формулы МО могут быть получены восстановлением оксидов более высокой валентности (М2О3, М3О4), а также окислением металла М, термическим разложением солей и гидроксидов без доступа воздуха.
Оксиды нерастворимы в воде, растворяются в кислотах с образованием оксоаквакатионов, придающих раствору зеленую окраску различных оттенков:
МО + 2Н3О+ + 3Н2О ⇄ [М(Н2О)6]2+
При подщелачивании этих растворов выпадают осадки гидроксидов основного характера М(ОН)2. Гидроксид Fе(ОН)2 — белого цвета (на воздухе зеленый за счет частичного окисления). Гидроксид Со(ОН)2 — синего цвета (на холоду, α-форма) или розового цвета (в теплом растворе, β-форма). При образовании коллоидного раствора появляется коричневое окрашивание. Гидроксид Ni(ОН)2представляет собой зеленые кристаллы.
Из трех перечисленных гидроксидов в аммиаке и солях аммония растворяется только Ni(ОН)2:
Ni(ОН)2 + 2NН4Сl + 4NН4ОН → [Ni(NН3)6]Сl2 + 6Н2О
Гидроксид никеля (II) окисляется на воздухе. Гидроксиды железа (II) и кобальта (II) окисляются (как и соли) лишь в присутствии влаги:
4Fе(ОН)2 + O2 + 2Н2О → 4Fе(ОН)3
Восстановительные свойства уменьшаются в ряду Fе2+ — Со2+ — Ni2+. У солей Ni2+восстановительные свойства практически отсутствуют.