Для установления оптимальных параметров гетерогенных процессов и их аппаратурного оформления и проектирования необходимо прежде всего изучить статику (т.е. равновесие) и кинетику (т.е. скорость) этих процессов. Равновесие в гетерогенных системах зависит от температуры, давления и концентрации как исходных реагентов, так и продуктов реакции, скорость же взаимодействия реагентов, находящихся в разных фазах, зависит не только от скорости химической реакции, но и от многих других факторов (как любой процесс, протекающий на макроуровне). Поэтому в общем виде скорость гетерогенного процесса выражается следующим уравнением
r = k×F×∆C, (3.1)
где r – скорость гетерогенного процесса; k – коэффициент скорости процесса; F – поверхность контакта фаз; ∆C – движущая сила процесса. Рассмотрим влияние различных факторов на каждый из параметров, входящих в уравнение (3.1), а также способы увеличения общей скорости процесса
Коэффициент скорости процесса. Коэффициент включает в себя многие факторы, влияющие на скорость гетерогенного процесса. В большинстве практических случаев влияние этих факторов неодинаково. Так, например, химический процесс обычно состоит из нескольких стадий, а его общая скорость определяется скоростью наиболее медленной (лимитирующей) стадии. Поэтому, для интенсификации процесса необходимо прежде всего определить, какая из стадий является наиболее медленной, и ускорить ее. Такими наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1) химическая реакция;
2) диффузия;
3) одновременно химическая реакция и диффузия.
В первом случае, скорость диффузии велика по сравнению со скоростью химической реакции; тогда говорят, что процесс протекает в кинетической области. Во втором случае, скорость химической реакции значительно больше скорости диффузии – процесс протекает в диффузионной области (во внешне- или внутридиффузионной). В третьем случае, скорости отдельных стадий соизмеримы, тогда говорят, что процесс протекает в переходной (смешанной) области.
После установления лимитирующей стадии процесса принимают меры, обеспечивающие повышение скорости этой стадии. Так, если процесс протекает в кинетической области, создают условия, ускоряющие химическую реакцию; если процесс протекает в диффузионной области, то ускоряют процесс диффузии; если же процесс протекает в переходной области, то создают условия, повышающие и скорость химической реакции (rх.р.), и скорость диффузии (rФ). Для установления лимитирующей стадии процесса существует несколько приемов. Рассмотрим наиболее важные из них.
Ранее было показано, что температура оказывает сильное влияние на скорость химических реакций. Так при увеличении температуры на 10 °С скорость химической реакции в некоторых случаях возрастает в 2–3 раза. Скорость диффузии газов зависит от температуры в значительно меньшей степени, приближенно эта зависимость выражается уравнением D = aT2, (3.2)
где D – коэффициент диффузии; a – постоянный коэффициент. Общая скорость процесса не может превышать самую низкую составляющую ее скорость rф ³ r £ rх.р.
Из уравнения (3.2) следует, что при повышении температуры на 10°С скорость диффузии увеличивается всего на 3…5 %. Это разное влияние температуры используют для определения лимитирующей стадии процесса. Лимитирующая стадия гетерогенного процесса может быть установлена опытным путем. Так, если опыт показывает, что повышение температуры оказывает сильное влияние на скорость процесса, то процесс протекает в кинетической области (рис. 3.2, область I). Если при дальнейшем повышении температуры ее влияние на скорость общего процесса уменьшается, значит процесс перешел в переходную область

Рис.3.2 Зависимость общей скорости процесса r от температуры Т: I- кинетическая область; II – переходная область; III – диффузионная область.
(рис. 3.2, область II). Если же далее при повышении температуры общая скорость процесса практически не изменяется, значит процесс протекает в диффузионной области (рис. 3.2, область III).
Изменение скорости потока также может быть использовано для определения лимитирующей стадии процесса, поскольку она оказывает существенное влияние на скорость внешней диффузии.
Так, на кривой зависимости общей скорости процесса от скорости потока r = f (w) можно выделить три области: диффузионную, переходную и кинетическую. В диффузионной области наблюдается значительное влияние скорости потока (рис.3.3, область I); в переходной области влияние скорости потока невелико (область II) и в кинетической области скорость потока не влияет на скорость процесса (область III).
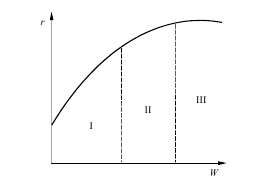
Рис. 3.3 Зависимость общей скорости процесса r от скорости потока w: I – диффузионная область; II – переходная область; III – кинетическая область
Влияние скорости потока на общую скорость процесса можно проследить также на графике, отражающем зависимость r = f (T), если нанести кривые этой зависимости для различных скоростей потока (рис. 3.4).
Ход кривых r = f (w) подтверждает тот факт, что область III является диффузионной (с увеличением w скорость процесса возрастает), и указывает на способ дальнейшего повышения общей скорости процесса в рассматриваемом случае.

Рис. 3.4 Зависимость общей скорости процесса r от температуры Т и скорости потока w (w1 < w 2 < w 3): I – кинетическая область; II – переходная область; III – диффузионная область
Влияние внутренней диффузии определяют проведением опытов с зернами различного размера. Опыты проводят при такой температуре и такой скорости потока, когда дальнейшее их увеличение не влияет на скорость процесса. Результаты опытов могут быть показаны в виде графической зависимости r = f (1/ R), где R – радиус частицы (рис. 3.5).Из рис. 3.5 видно, что при 1/R < 1/R1 размер частиц оказывает влияние на общую скорость процесса следовательно, эта область является внутридиффузионной. Чтобы получить представление о взаимном влиянии скорости внешней диффузии (rф) и скорости химической реакции (rх.р) на общую скорость гетерогенного процесса, рассмотрим процесс химического взаимодействия между газом и твердым реагентом, когда необратимая

Рис. 3.5 Зависимость общей скорости процесса r от радиуса частиц твердого реагента R
реакция первого порядка протекает с образованием газообразного продукта. Последний диффундирует через пограничный слой газа и попадает в основной его поток. Реакция протекает по уравнению
A(г) + B(т) → R(г), (3.3)
где индекс (г) относится к газу, индекс (т) относится к твердому реагенту. Реакция протекает на плоской поверхности твердого реагента, к которой из турбулентного потока газа диффундирует исходный реагент A через прилегающий к поверхности пограничный слой газа толщиной δ. При этом изменение концентрации по толщине слоя происходит по линейному закону (рис. 3.6).

Рис. 3.6 Схема взаимодействия газообразного реагента А с твердым реагентом В: 1 – газ: 2 – твердый реагент; 3 – пограничный слой газа.
В данном случае процесс включает диффузионный (физический) пере- нос газообразного реагента, скорость которого rф, и химическую реакцию, скорость которой rх.р.. Скорость диффузионного переноса реагента, отнесенная к единице поверхности, выражается уравнением
rФ =  D
D  (3.4, а)
(3.4, а)
где D – коэффициент диффузии; δ – толщина пограничного слоя газа;
∆C – движущая сила процесса, равная
DC = CА,г – СА,т (3.4, б)
где CA,г и CA,т – концентрация реагента A в объеме газа и у твердой по- верхности (в зоне реакции). Подставив значение C∆ из уравнения (3.4, б) в уравнение (3.4, а), находим
rФ =  (3.4, в)
(3.4, в)
где β – коэффициент скорости массоотдачи в газовой фазе, отнесенный к единице поверхности b=D/d.
Скорость химического взаимодействия для рассматриваемой реакции выражается уравнением rх.р. = -kтСА,т (3.4, г)
Для установившегося процесса rФ = rх.р (3.4,д)
Следовательно, rФ = rх.р = 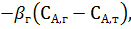 = -kтСА,т, (3.4, е)
= -kтСА,т, (3.4, е)
откуда
СА,т =  (3.5)
(3.5)
Из уравнения видно, что СА,т = f(bг, kт), т.е. СА,т зависит и от скорости диффузионного переноса, и от скорости химической реакции.
Подставив в уравнение 34.4, е) значения СА,т из уравнения (3.5), получаем
rФ = rх.р = -kтСА,т = 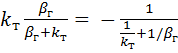 (3.6)
(3.6)
Так как концентрацию, реагента А в зоне реакции C A, г определить невозможно и, следовательно, нельзя определить движущую силу процесса ∆С = СА,г – СА,т, отнесем общий коэффициент скорости процесса К к концентрации исходного, реагента в основном газовом потоке CА,г, т.е. на границе пограничного слоя газа. При этом получим
-К = rх.р./СА,г = rФ /СА,г (3.7)
Из уравнения (3.6) находим
К= 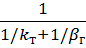 (3.8)
(3.8)
Или 1/К = 1/kт + 1/bг (3.9)
Из приведенных данных следует, что для реакции первого порядка, когда концентрация исходного реагента изменяется по толщине пограничного слоя по линейному закону, обратная величина коэффициента скорости процесса является суммой химического и диффузионного сопротивлений. Анализируя уравнение (3.9), можно установить влияние отдельных параметров на величину К. Если kт >> βг, из уравнения (3.9) следует 1/К = 1/bг или К = bг., т.е. общая скорость процесса определяется скоростью диффузии (процесс протекает в диффузионной области). Для повышения скорости такого процесса необходимо увеличить коэффициент βг. Обычно это осуществляют путем уменьшения толщины, пограничного слоя газа [δ в уравнении (3.4 а)]. Для этого увеличивают скорость газового потока или усиливают его турбулизацию.
Когда βг << kт, из уравнения (3.9) следует, что K ≈ kт. Следовательно, общая скорость процесса определяется скоростью химической реакции (процесс протекает в кинетической области). Для увеличения kт и общей скорости процесса необходимо повышать температуру (величина kт экспоненциально возрастает при повышении температуры или применять катализатор, снижающий энергию активации. При протекании сложных реакций применяют катализатор селективного действия.
Коэффициент скорости процесса К зависит от многих показателей, поэтому способы его увеличения устанавливают с учетом особенностей каждого химико- технологического процесса.
Поверхность контакта фаз. Поверхность контакта фаз может быть увеличена главным образом за счет соответствующего аппаратурного оформления процесса, т.е. путем применения различных по устройству реакторов. Например, в системе г – ж процесс часто проводят в башнях с насадкой или в полых башнях. В первом случае насадка орошается жидкостью, которая, стекая вниз, смачивает насадку (рис. 3.8). Газ проходит через насадку и соприкасается с жидкостью, смачивающей насадку. Поверхность жидкости, т.е. поверхность контакта фаз (F), тем больше, чем больший объем насадки приходится на единицу объема пропускаемого газа, чем меньше размер насадки и чем более развита поверхность этой насадки. Поверхность одного кубометра различных по размерам и устройству насадок приведена в справочной литературе. Так, например, суммарная поверхность правильно уложенных керамических колец размером 50 х 50 х 5 мм составляет 100 м 2/ м 3, а колец размером 100 х100 х10 – 60 м 2/м 3.

Рис. 3.7 Реакторы для осуществления химических процессов г – ж: а – башня с насадкой; б – полая башня; 1 – башня, 2 – холодильник; 3 – насос
В полых башнях поверхностью соприкосновения фаз служит поверхность капель, образующихся при разбрызгивании жидкости в башне с помощью различных устройств (рис. 3.7, б). Общая поверхность (поверхность контакта фаз F) определяется по формуле
F = 0,3/rR, (3.10)
где F – поверхность, приходящаяся на 1 кг разбрызгиваемой жидкости; ρ – плотность жидкости, г/см 3 ; R – радиус капель, см. Так, если плотность жидкости ρ = 1 г/см 3, из уравнения (3.10) следует
R, см …………………………….. 1,0 0,1 0,01 0,001
F, м 2 ……………………………... 0,3 3 30 300
В некоторых случаях в системах г – ж процесс осуществляется в барботажных и пенных аппаратах, в которых газ в виде отдельных пузырьков барботирует через слой жидкости. При этом поверхностью контакта служит внутренняя поверхность пузырьков: чем меньше размер пузырьков газа и чем выше слой жидкости, тем больше поверхность F. Для системы г – т увеличение поверхности соприкосновения фаз достигается измельчением твердой фазы. Газообразное вещество приводят в соприкосновение с измельченным исходным веществом самыми разнообразными способами, например, твердые частицы вещества располагают на полках реактора, а поток газа движется над полками. В других случаях тонко измельченное твердое исходное вещество распыляют в потоке газообразного исходного вещества в полом объеме; таким образом сжигают пылевидное топливо в топках паровых котлов. В реакторах с псевдоожиженным (кипящим) слоем поверхность соприкосновения фаз тем больше, чем мельче частицы зернистого материала и чем выше слой этого материала.
Движущая сила процесса. Движущая сила процесса выражается уравнением
DС =Сп.ф.- Сз.р., (3.11)
где C п.ф. – концентрация исходного вещества в передающей фазе; C з.р – концентрация исходного вещества в той же фазе в зоне реакции.
Из уравнения (3.11) следует, что существуют два способа повышения ∆C за счет увеличения Cп.ф. и снижения C з.р.. Движущая сила процесса возрастает, если увеличить концентрацию исходных реагентов в пере- дающей фазе (Cп.ф.) или повысить давление, а также если выводить продукты реакции из сферы взаимодействия. Увеличение давления является эффективным способом повышения ∆ С, особенно для системы г – ж, так как в этом случае DС =рг –р*,
где р г – давление исходного газообразного реагента в газовой фазе; р* – равновесное давление исходного реагента у поверхности жидкости.
При повышении давления процесса рг увеличивается, а р* остается постоянным, следовательно, при увеличении давления растеттакже ∆С.Вывод продуктов из сферы реакции также является эффективным способом увеличения движущей силы и широко используется в самых разнообразных производственных процессах. При выводе продуктов реакции из зоны реакции уменьшается объем реакционной смеси, а Сг (или рг) соответственно увеличивается. Рост ∆ С за счет снижения р* на практике осуществляется редко. Для систем г – ж это достигается путем уменьшения температуры, так как одновременно понижается равновесное давление вещества над жидкостью (р*). Однако практические возможности для использования этого приема ограничены, поскольку при понижении температуры сильно уменьшается константа скорости реакции (уравнение Аррениуса) и общая скорость процесса.

Рис.3.8 Изменение движущей силы процесса ∆ С во времени t
По мере протекания реакции концентрация Сг уменьшается, соответственно снижается движущая сила ∆С, а также уменьшается общая скорость процесса, поэтому на практике в целях поддержания высокой скорости процесса его ведут при достаточно большом значении ∆С, ограничивая время пребывания реакционной смеси в реакторе некоторым оптимальным значением tопт (рис. 3.8).
Вопросы для самоконтроля
1. Что такое гомогенные и гетерогенные процессы?
2. От чего зависит скорость гомогенного процесса?
3. Приведите примеры гомогенных и гетерогенных реакций.
4. Что такое порядок и молекулярность реакции?
5. От каких факторов зависит скорость гетерогенного процесса?
6. Зависимость скорости гетерогенного процесса от поверхности контакта.
7. Зависимость скорости гетерогенного процесса от коэффициента скорости процесса
8. Способы повышения движущей силы гетерогенных процессов.
9. Стадии гетерогенного процесса
10. Способы увеличения поверхности контакта фаз в системах Ж – Т, Г - Ж, Г - Т