Одним из наиболее перспективных способов получения электроэнергии является электрохимический способ преобразования химической энергии, который осуществляется в химических источниках тока (ХИТ).
ХИТ как источники электрической энергии имеют ряд несомненных преимуществ: они обладают высоким КПД преобразования энергии (до 90%), не имеют подвижных, подверженных износу частей, бесшумны в работе, малочувствительны к вибрации и изменению температуры, экологически безвредны, полностью автономны.
К химическим источникам тока относят гальванические элементы, аккумуляторы и топливные элементы.
Гальваническими элементами называют устройства для прямого преобразования химической энергии заключенных в них реагентов в электрическую. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. После расхода реагентов элемент не может быть возвращен в рабочее состояние. Такие элементы относят к первичным химическим источникам тока – это источники тока одноразового действия.
Принцип работы гальванического элемента рассмотрим на примере элемента Даниэля-Якоби, схема которого приведена на рис. 5.3.
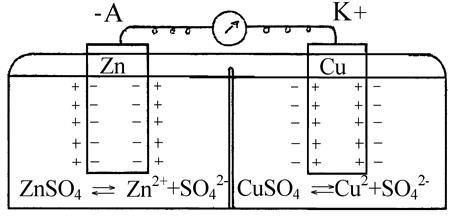
Рисунок 5.3 – Электрохимический элемент
Он состоит из медной пластины, погруженной в раствор сернокислой меди  и цинковой пластины, погруженной в раствор сернокислого цинка
и цинковой пластины, погруженной в раствор сернокислого цинка  . Для предотвращения прямого воздействия окислителя и восстановителя электроды отделены друг от друга пористой мембраной.
. Для предотвращения прямого воздействия окислителя и восстановителя электроды отделены друг от друга пористой мембраной.
При погружении металла в раствор происходит сложное взаимодействие металла с компонентами раствора, в результате которого происходит окисление металла и его ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле. Металл становится заряженным отрицательно, а раствор положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла, создавая на границе металл-раствор двойной электрический слой. Между металлом и раствором возникает разность потенциалов, называемая потенциалом электрода.
На поверхностях металлических пластин устанавливается электрическое равновесие:
на медной
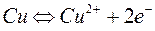 ,
,
на цинковой
 .
.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделение меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится вся медь).
Основными параметрами гальванических элементов являются ЭДС, напряжение, емкость и удельная энергия.
Электродвижущая сила – разность потенциалов между электродами в режиме холостого хода, т.е. режима, когда через элемент не проходит электрический ток. ЭДС элемента не зависит от его размеров, а определяется типом используемых электродов и концентрацией электролита. По мере работы элемента (разряда) уменьшается концентрация исходных реагентов и растет концентрация продуктов реакции, что приводит к постепенному уменьшению ЭДС.
Напряжение элемента – разность потенциалов на электродах в процессе прохождения тока. Напряжение элемента всегда меньше ЭДС из-за поляризации электродов и падения напряжения на внутреннем сопротивлении. Внутренне сопротивление элемента растет с увеличением плотности тока, что приводит к уменьшению его напряжения. Зависимость величины напряжения элемента от силы или плотности тока называется вольт-амперной характеристикой элемента. Кривая изменения напряжения во времени в процессе разряда называется разрядной кривой элемента.
Емкость элемента – выраженное в кулонах или ампер-часах количество электричества, которое элемент способен отдать при полном разряде. Она зависит от массы реагентов в элементе и их свойств.
При разряде элемента постоянным током  , емкость определяется из выражения:
, емкость определяется из выражения:
 , (5.4)
, (5.4)
энергию элемента можно найти из уравнения:
 , (5.5)
, (5.5)
если элемент разряжается при постоянном внешнем сопротивлении  , то его емкость и энергия определяются из выражений:
, то его емкость и энергия определяются из выражений:
 , (5.6)
, (5.6)
 , (5.7)
, (5.7)
где 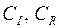 – емкость элемента при постоянном токе или постоянном внешнем сопротивлении, соответственно, А·ч;
– емкость элемента при постоянном токе или постоянном внешнем сопротивлении, соответственно, А·ч;  – энергия элемента, которую он отдает во внешнюю цепь, Вт·ч;
– энергия элемента, которую он отдает во внешнюю цепь, Вт·ч;  – среднее напряжение при разряде элемента, В;
– среднее напряжение при разряде элемента, В;  – время разряда элемента, ч.
– время разряда элемента, ч.
Удельная энергия – энергия, которую отдает элемент во внешнюю цепь, отнесенная к единице его массы или объема. Значения удельной энергии элемента характеризуют его качество.
Для увеличения рабочего напряжения или емкости гальванических элементов используют электрические батареи. Электрической батареей называется комбинация включенных параллельно или последовательно двух или более электрохимических элементов. Батареи являются удобными накопителями энергии, которые в течение короткого периода времени могут поддерживать довольно большой ток при сравнительно стабильном напряжении. Они отличаются компактностью, просты в эксплуатации и практически не загрязняют окружающую среду. Тип батареи для конкретных условий работы выбирается по количеству запасаемой энергии на единицу массы и номинальному напряжению.
Гальванические батареи находят широкое применение в качестве источников питания разнообразных приборов: фонариков, часов, радиоприемников и т.п. Существенным недостатком гальванических элементов является явление саморазряда – использование электрохимически активных веществ при отсутствии внешнего тока, которое существенно сокращает срок службы элемента.
Устройства, в которых происходят обратимые процессы преобразования химической и электрической энергии, называются аккумуляторами. Процесс накопления химической энергии под действием внешнего источника тока называется зарядом, процесс превращения химической энергии в электрическую – разряд аккумулятора. Аккумуляторы допускают многократные процессы заряда/разряда.
Простейший аккумулятор должен иметь два электрода – анод и катод, помещенных в электролит, который обеспечивает обмен ионами между электродами.
Наиболее распространенным типом восстанавливаемых электрохимических элементов является свинцовый (кислотный) аккумулятор, который широко используется в автомобилях. Анодом в этом аккумуляторе является пористый свинец, а катодом – набор сеток, заполненных перекисью свинца ( ). Электролитом служит слабо концентрированная серная кислота (
). Электролитом служит слабо концентрированная серная кислота ( ), которая при взаимодействии с оксидом свинца образует новое химическое соединение –
), которая при взаимодействии с оксидом свинца образует новое химическое соединение –  .
.
При заряде аккумулятора активная масса одного электрода превращается из  в
в  , а активная масса второго электрода из
, а активная масса второго электрода из  превращается в
превращается в  . Разряд аккумулятора происходит с образованием свободных электронов и воды, которая понижает концентрацию серной кислоты. Снижение концентрации электролита приводит к падению ЭДС и напряжения аккумулятора. В начале разряда напряжение падает относительно медленно, однако при напряжении ниже 1,7 В (плотность
. Разряд аккумулятора происходит с образованием свободных электронов и воды, которая понижает концентрацию серной кислоты. Снижение концентрации электролита приводит к падению ЭДС и напряжения аккумулятора. В начале разряда напряжение падает относительно медленно, однако при напряжении ниже 1,7 В (плотность  1,17 г/см3) скорость уменьшения напряжения резко возрастает. При этом на электродах образуется неактивная пленка особой кристаллической структуры, которая изолирует активную массу электрода от электролита – эффект сульфатирования. Поэтому для продления срока службы кислотных аккумуляторов не рекомендуется их глубокий разряд – ниже 70% от первоначальной емкости.
1,17 г/см3) скорость уменьшения напряжения резко возрастает. При этом на электродах образуется неактивная пленка особой кристаллической структуры, которая изолирует активную массу электрода от электролита – эффект сульфатирования. Поэтому для продления срока службы кислотных аккумуляторов не рекомендуется их глубокий разряд – ниже 70% от первоначальной емкости.
Широкому распространению свинцовых аккумуляторов способствуют их очевидные достоинства: высокий КПД преобразования энергии (около 80%), большая величина ЭДС и ее относительно малое изменение при неглубоком разряде, простота конструкции и низкая себестоимость.
Однако, свинцовые аккумуляторы тяжелы и громоздки, имеют низкую удельную энергию на единицу массы (20-30 Вт·ч/кг), небольшой срок службы (2-5 лет), подвержены саморазряду. Тем не менее их широко используют на автомобилях, самолетах, железных дорогах, элекрокарах и других устройствах, где необходим простой идешевый автономный источник электроэнергии.
Другим распространенным типом аккумуляторных батарей являются аккумуляторы, у которых в качестве электролита вместо кислоты используется щелочь. Наибольшее распространение среди щелочных аккумуляторов получили никель-кадмиевые и никель-железные аккумуляторы. Большинство реагентов щелочных аккумуляторов находятся в твердом состоянии, что обеспечивает стабильную величину ЭДС на их электродах и герметичность конструкции. К достоинствам щелочных аккумуляторов относится большой срок службы (до 10 лет), высокая механическая прочность, отсутствие необходимости замены реагентов. Из недостатков можно отметить невысокие значения КПД (60-65%) и небольшую величину ЭДС.
Щелочные аккумуляторы находят применение в качестве источников питания погрузчиков, рудничных электровозов, различной электронной аппаратуры.
Новые разработки направлены на создание батарей с большими удельными запасами энергии, большей удельной мощностью и более малогабаритных либо более дешевых. В последние годы исследования концентрировались вокруг электрохимических источников, электродами в которых являются щелочные металлы и галогены.
Разработаны никель-цинковые аккумуляторы с удельной энергией 50 Вт·ч/кг, ведутся разработки серно-натриевых аккумуляторов с твердым электролитом, удельная энергия которых достигает 100-200 Вт·ч/кг. Данные разработки особенно важны для крупных городов, сложная экологическая обстановка которых во многом связана с наличием большого количества автотранспорта с двигателями внутреннего сгорания. Использование аккумуляторов с большой удельной энергией позволит значительно улучшить экологию населенных пунктов за счет применения электроавтотранспорта.
Отдельным типом электрохимических элементов является топливный элемент. Топливный элемент отличается от выше рассмотренных электрохимических элементов тем, что активные вещества к нему подаются извне, а электроды в электрохимических превращениях не участвуют. Так как окислитель и восстановитель хранятся вне топливного элемента, а его электроды во время работы не расходуются, он может эксплуатироваться длительное время. Обычно в топливных элементах используют жидкие или газообразные восстановители (водород, метанол, углеводороды) и окислители (кислород и пероксид водорода).
На рис. 5.4 приведена принципиальная схема водороднокислородного топливного элемента с щелочным электролитом. Топливный элемент состоит из анода 1, катода 3 и ионного проводника 2. К аноду подводится топливо (восстановитель), в данном случае водород, к катоду – окислитель, обычно чистый кислород или кислород воздуха.
На аноде элемента протекает химическая реакция окисления водорода:

на катоде восстанавливается кислород:
 .
.
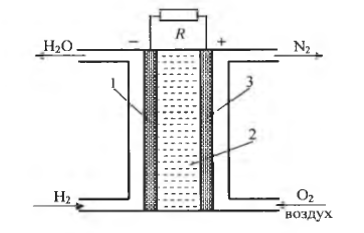
Рисунок 5.4 – Схема кислородно-водородного топливного элемента
Во внешней цепи происходит движение электронов от анода к катоду, а в растворе – движение ионов  от катода к аноду. Если просуммировать уравнения анодной и катодной реакций топливного элемента, получим уравнение токообразующей реакции:
от катода к аноду. Если просуммировать уравнения анодной и катодной реакций топливного элемента, получим уравнение токообразующей реакции:
 .
.
В результате протекания этой реакции во внешней цепи генерируется постоянный ток, и химическая энергия непосредственно превращается в электрическую.
Использование водорода в качестве топлива сопряжено с высокой стоимостью эксплуатации топливных элементов, поэтому изыскиваются возможности применения других видов топлива, в первую очередь природного и генераторного газа. Однако, процесс окисления природных видов топлива при низких температурах происходит с очень малыми скоростями. Для увеличения скорости электроокисления природного топлива разработаны высокотемпературные топливные элементы, с рабочей температурой 500-1000ºС. В качестве электролита в этих элементах используют расплавленные соли или твердые ионные проводники.
Разработаны также углеводородные элементы – керосиновый, гидразиновьй и формальдегидный, в которых, электролитом служит расплав карбоната щелочного металла.
В отличие от гальванических элементов для непрерывного производства электроэнергии топливные элементы требуют ряда дополнительных устройств, обеспечивающих хранение и подвод топлива и окислителя, отвода продуктов реакции, поддержании в заданных пределах напряжения и температуры. Весь комплекс оборудования для производства электрической энергии на основе топливных элементов называется электрохимической энергооустановкой.
Созданы опытные образцы электрохимических энергоустановок на мощности от десятков ватт до тысяч киловатт. Они имеют высокий КПД (60-80%), бесшумны в работе, экономичны, у них отсутствуют вредные отходы. Наиболее разработаны кислородно-водородные энергетические установки, которые уже много лет с успехом эксплуатируются на космических кораблях. Они обеспечивают космические корабли не только электроэнергией, но и водой, которая является продуктом реакции в топливном элементе. Удельная энергия этих установок составляет 400-800 Вт·ч/кг, а КПД – 60-70% [6].
Создание дешевых топливных элементов с высоким КПД, работающих на органическом топливе, в широких масштабах позволило бы сохранить топливные ресурсы планеты на многие столетия. Широкомасштабное использование электрохимических энергоустановок сдерживается их небольшим сроком службы и высокой стоимостью.
Водородная энергетика
Одной из наиболее заманчивых перспектив развития энергетики является использование в качестве основного энергоносителя водорода. Этому есть ряд веских причин: водород является одним из самых распространенных химических элементов на Земле, его можно получать из воды океанов, запасы которой практически не ограничены; водород имеет по сравнению с другими видами топлив самую высокую теплоту сгорания на единицу массы (молекулярный водород содержит в себе в 3 раза больше энергии, чем равное ему по весу количество бензина – 143 МДж/кг против 46 МДж/кг); водород экологически чистый энергоноситель – основным продуктом его сгорания является вода.
Важным положительным свойством водорода является возможность его использования в традиционных энергетических установках при их незначительной модификации. Водород можно использовать в качестве топлива тепловых электростанций вместо угля, мазута и газа, заправлять им автомобили и самолеты вместо бензина и керосина, получив тем самым экологически безупречный транспорт.
С помощью водорода можно аккумулировать энергию, вырабатываемую атомными, солнечными и ветряными электростанциями в часы минимума нагрузок. Дня перекачки водорода можно использовать существующие трубопроводы, служащие для транспортировки природного газа. При этом ввиду высокой энергетической плотности водорода, затраты на его доставку к электростанциям оцениваются в 10-15 ниже затрат на транспортировку электрической энергии.
Возможность использования водорода в качестве основного энергоносителя в технологических процессах получения, аккумулирования и транспортировки энергии, позволяет рассматривать водородную энергетику как серьезную альтернативу энергетике традиционной. Однако для практического воплощения в жизнь идей водородной энергетики требуется огромное количество водорода.
Важно отметить, что водород не является первичным источником энергии. Водород – это не топливо, он является только носитель энергии, как электричество. Водород гораздо легче сохранять, чем электроэнергию, но, чтобы выделить водород из связанных с ним химических элементов, необходимо затратить определенное количество энергии.
Вместе с тем, кроме отмеченных выше достоинств, водород имеет и ряд недостатков.
Он в восемь раз легче природного газа, а его объемная теплота сгорания в 3,3 раза меньше, чем у метана.
Водород образует с воздухом взрывоопасные смеси в значительно большем диапазоне концентраций, чем природный газ.
Температура сжижения водорода существенно ниже, чем у метана.
Ключевым вопросом развития водородной энергетики является разработка рентабельных технологий производства водорода. Существует множество технологий получения водорода, среди которых можно отметить каталитическую конверсию, термохимические и термоэлектрохимические методы разложения воды, электролиз воды (см. рис. 5.5).

Рисунок 5.5 – Основные источники и пути получения водорода
В настоящее время в мире большая часть производимого в промышленном масштабе водорода получается в процессе паровой конверсии метана. Полученный таким путем водород используется как реагент для очистки нефти и газа от примесей, как компонент азотных удобрений, топливо для ракетной техники. При температуре пара около 800°С происходит разложение метана и выделение водорода, осуществляемое на каталитических поверхностях. Достоинством технологии являются относительно невысокие термические параметры химических реакций и то, что примерно половина водорода при паровой конверсии производится не из метана, а из воды. Однако, метод каталитической конверсии углеводородов нельзя считать перспективным из-за слишком высоких затрат энергии (порядка 20 МДж/м3 водорода) и в связи с сокращением запасов природного сырья – нефти или газа.
Другой способ получения водорода основан на использовании термохимических реакций с участием химически активных соединений йода или брома. Нагревая воду до температуры свыше 2500°С, можно реализовать реакцию ее термолитического разложения на кислород и водород. Первичным продуктом служит вода, а сам процесс осуществляется в несколько циклов. Сложность этого процесса состоит в том, что трудно предотвратить обратную реакцию рекомбинации паров воды.
Третья технология производства водорода – это электролитическое разложение воды. Электролиз можно осуществлять под высоким давлением и получать высокий выход водорода. Недостатком этого метода является значительный уровень потребления электроэнергии.
Для производства водорода выгодно использовать тепловую и электрическую энергию, вырабатываемую АЭС и ГЭС в так называемом провальном режиме, то есть в ночное время, когда падает уровень обычного потребления энергии.
Из существующих технологий крупномасштабного производства водорода предпочтение следует отдать электролитической технологии. Однако и в этом случае затраты электроэнергии недопустимо велики – не менее тех же 20 МДж в расчете на 1 м3 чистого водорода. Если рассчитывать на производство водорода на АЭС и ГЭС в непиковые режимы работы, то расход энергии можно будет снизить более чем в 2 раза.
Согласно данным Минэнерго США, в современных условиях стоимость производства водорода методом паровой конверсии составляет 7 долл/ГДж (для условий большого завода), что уже соизмеримо со стоимостью традиционного автомобильного топлива. Расчет, выполненный специалистами РНЦ «Курчатовский институт» с учетом отечественных цен на газ, привел их к выводу, что водород будет более дешевым источником энергии по сравнению с бензином при текущих внутренних ценах на углеводородное топливо. Производство водорода электролизом воды на основе современных технологий оценивается по затратам от 10 до 20 долл. за ГДж.
Снижение цены водорода возможно при строительстве инфраструктуры по доставке и хранению водорода. В США действует 750 километров, а в Европе 1500 километров водородных трубопроводных систем. Трубопроводы действуют при давлении 10-20 бар, изготовлены из стальных труб диаметром 25-30 см. Старейший водородный трубопровод действует в районе германского Рура. 210 километров трубопровода соединяют 18 производителей и потребителей водорода. Трубопровод действует более 50 лет без аварий. Самый длинный трубопровод длиной 400 километров проложен между Францией и Бельгией.
Водород в настоящее время, в основном, применяется в технологических процессах производства бензина, и для производства аммиака. США ежегодно производят около 11 миллионов тонн водорода, что достаточно для годового потребления примерно 35-40 миллионов автомобилей.
Ожидается, что к 2100 г. производство водорода достигнет 770-950 миллионов тонн (в 2000 г. оно составляло 50 Мт). Это приведет к формированию крупнейшего нового сектора мировой экономики. В качестве сопутствующих технологий самое широкое применение должны получить топливные элементы.
К концу 2006 года во всём мире было установлено более 800 стационарных энергетических установок на топливных элементах мощностью более 10 кВт. Их суммарная мощность – около 100 MB. За 2006 год построено более 50 установок суммарной мощностью более 18 МВт.
Потребность в топливных элементах для децентрализованной стационарной энергетики (мощностью 250 кВт – 10 МВт) в ближайшие 10 лет составляет 100000 МВт. Стоимость 1 кВт планируется довести с современных 3000-6000 долл. до 1000-1500 долл. к 2015 г. Потребность в топливных элементах для автотранспорта (мощностью 25-50 кВт) составляет 500 тыс. штук в год. Стоимость киловатта планируется довести с современных 3000-1000 до 100-50 долл [7].
Большое внимание развитию водородной энергетике уделяется и в России. В 2005 «Норильский никель» основал инновационную компанию «Новые энергетические проекты», задачей которой является разработка и внедрение топливных элементов.
В 2006 «Норильский никель» приобрел контрольный пакет американской инновационной компании Plug Power, являющейся одним из лидеров в сфере разработок, связанных с водородной энергетикой.
Предполагается, что на основе российских и американских разработок с 2008 начнётся производство водородных энергетических установок в России.
Контрольные вопросы
1. Физический смысл термоэлектрического эффекта.
2. Принцип работы термоэлектрического генератора.
3. Преимущества термоэлектричексих генераторов.
4. Принцип работы магнитогидродинамического генератора.
5. Открытый и замкнутый цикл работы установок с магнитогидродинамическим генератором.
6. Преимущества, особенности и трудности создания магнитогидродинамического генератора.
7. Преимущества химических источников тока.
8. Принцип работы гальваническго элемента Даниэля-Якоби.
9. Основные параметры гальванических элементов.
10. Классификация аккумуляторов.
11. Виды топливных элементов.
12. Достоинства и недостатки водорода как энергоносителя.
13. Пути и способы получения водорода.
14. Развитие водородной энергетики в России и мире.