Лекция 12
Элементы физики молекул
План лекции:
1. Виды химической связи в молекулах: ионная, ковалентная. Молекулярный ион 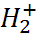 . Молекула водорода. Многоатомные молекулы.
. Молекула водорода. Многоатомные молекулы.
2. Люминесценция и ее виды. Закон Стокса. Закон Вавилова.
3. Применение люминесценции.
Вопрос 1. Виды химических связей в молекулах
Молекула – наименьшая частица вещества, обладающая основными химическими свойствами этого вещества.
Молекула может состоять из одинаковых или различных атомов, соединенных между собой в одно целое химическими связями. Число атомов в молекуле может меняться от двух (кислород, водород, азот) до многих тысяч (ДНК, полимеры). Если молекула состоит из большого числа чередующихся групп атомов, ее называют макромолекулой. Первые представления о молекулах возникли в 18 веке в связи с развитием термодинамики и молекулярно – кинетической теории газов. Размеры (диаметры) молекул определяются числом содержащихся в них атомов и варьируются в пределах 10-8 – 10-7 см. это означает, что 10 миллионов молекул, уложенные вплотную друг к другу вдоль прямой линии, составят молекулярную цепочку длиной всего лишь 1 – 10 мм. Очевидно, что при столь малом размере атомов и молекул число их в физическом теле должно быть колоссальным. Например в одной капле воды содержится 3*1021 молекул.
Электроны в молекулах, как и в атомах, располагаются, образуя молекулярные электронные оболочки. Химические и большинство физических свойств молекул определяются их внешними электронами, причем внутренние электронные оболочки атомов практически не изменяются при объединении атомов в молекулу и не влияют на свойства молекул. Наиболее общими характеристиками молекул являются ее молярная масса, элементный состав и структурная формула, указывающая последовательность расположения атомов и химических связей в молекуле (например, молекулярная масса воды равна 18 а.е.м., ее состав H2O, структурная формула H – O – H).
Возможность существования молекулы как устойчивого микрообразования обусловлена тем, что внутренняя энергия молекулы как системы атомов оказывается меньше суммарной энергии всех составляющих ее атомов в изолированном состоянии. Соответствующая разность энергий называется энергией образования молекулы.
Она примерно равна сумме энергий химических связей. При классификации молекул обычно выделяют 2 вида химических связей в молекулах: ионную и ковалентную, хотя в ряде молекул реализуются и промежуточные виды связей.
Ионная связь
Ионная связь осуществляется благодаря электростатическому взаимодействию ионов, которые образуются при переходе одного или нескольких электронов от одного атома к другому. Ионными молекулами являются NaCl, LiF, KJ и другие. А так как они состоят из ионов, атомы которых существенно различающимися свойствами, то связь между ними называется ионной или гетерополярной.
На примере молекулы LiF проиллюстрируем процесс образования ионной молекулы из атомов.
Для существования устойчивой системы, какой является молекула, необходимо, чтобы суммарная энергия Е молекулы LiF, состоящей из ионов Li+ и F-, была меньше суммарной энергии Е0 нейтральных атомов лития и фтора в свободном состоянии. В грубом приближении разность Е1 – Е0 можно выразить через энергию ионизации атома Li (Eи=5,4 эВ) и сродство к электрону атома фтора (Ес=3,6 эВ).
 (1)
(1)
Зависимость энергии ∆E от расстояния R между ионами Li+ и F- в молекуле LiF показана на рисунке 1:

Оказывается, что энергия ∆E минимальна при значении R0=1.5*10-10 м, что соответствует равновесному значению длины химической связи в молекуле LiF.
На меньших расстояниях R (R<R0) энергия ∆E резко возрастает из-за отталкивания внутренних электронных оболочек ионов Li+ и F-, которое возникает вследствие перекрытия волновых функций электронов Li+ и F- (обменные квантово-механические силы).
Энергия диссоциации D молекулы на отдельные атомы определяется значением энергии ∆E в точке минимума. Для молекулы LiF:
 (2)
(2)
Ковалентная связь
Ковалентная, или гомеополярная связь возникает при обобществлении электрона или электронных пар, находящихся одновременно у двух одинаковых атомов или атомов с близкими свойствами.
Атомы в таких молекулах могут быть соединены одинарной (H2, H3C – CH3), двойной (H2C = CH2) или тройной (N2, C2H2) ковалентной связью.
При образовании таких молекул возникает деформация внешних электронных оболочек исходных атомов, а также происходит перекрытие этих оболочек по линии, соединяющей центры атомных ядер.
На некотором расстоянии между ядрами силы притяжения уравновешиваются силами отталкивания, т.е. образуется устойчивая система атомов (молекула), обладающая минимумом внутренней энергии.
Рассмотрим особенности образования ковалентной связи на примере простейших двухатомных систем – молекулярного иона  и молекулы водорода H2.
и молекулы водорода H2.
Молекулярный ион 

Данный ион состоит из двух протонов H+ и одного электрона, который образует электронное облако вокруг двух протонов, расположенных на некотором расстоянии R. Полная энергия иона (см. рис. 2) равна сумме кинетической энергии электрона (протоны считаются неподвижными) и потенциальной энергии взаимодействия протонов H+ между собой и движущимся электроном:
 (3)
(3)
Два первых слагаемых в формуле (3) определяют энергию притяжения электрона протонами, третье – энергию отталкивания ядер.
На рисунке 3 схематично представлена зависимость энергии E0=f(R) для основного состояния электрона в ионе  :
:

В области значений R>R0 преобладают силы притяжения, обусловленные обменными квантово-механическими силами взаимодействия протонов через посредство электрона, который находится преимущественно в области между протонами. При R<R0 ядра отталкиваются друг от друга.
Каждое возбужденное состояние электрона характеризуется определенным равновесным расстоянием R0 и соответствующей энергией диссоциации иона  :
:
 (4)
(4)
Молекула водорода H2
В молекуле водорода, как и в молекулярном ионе  , осуществляется ковалентная связь, однако, она образуется с помощью двух электронов. Потенциальную энергию молекулы рассчитывают по формуле:
, осуществляется ковалентная связь, однако, она образуется с помощью двух электронов. Потенциальную энергию молекулы рассчитывают по формуле:
 (5)
(5)
Эта энергия зависит от всех взаимных расстояний между электронами и протонами ( ,
,  ).
).
Многоатомные молекулы
Молекулы, состоящие из трех и более атомов, называются многоатомными.
Главным требованием устойчивости многоатомной молекулы является требование, чтобы энергия ее электронной конфигурации, зависящая от взаимного расположения ядер атомов, была минимальной.
В многоатомных молекулах, как и в двухатомных, химическая связь может быть ковалентной, ионной, смешанной. Ковалентная связь между атомами осуществляется парами электронов. Прочность химических связей, т.е. энергия связи, зависит от степени перекрывания волновых функций валентных электронов. Иначе, чем больше перекрываются их электронные оболочки при образовании молекулы, тем сильнее обменные квантово-механические взаимодействия между атомами, образующими связь.
Вопрос 2. Люминесценция
Свечение вещества (т.е. испускание видимого света), обусловленное переходами атомов и молекул с высших энергетических уровней на низшие, называется люминесценцией или холодным свечением.
Люминесценции должно предшествовать возбуждение атомов или молекул вещества.
После устранения возбудителя люминесценция продолжается в течение некоторого промежутка времени, зависящего от природы люминесцирующего вещества и изменяющегося в широких пределах: от миллиардных долей секунды до многих часов и даже суток.
Изучал люминесценцию, академик С.И. Вавилов (1891 – 1951). Им и его сотрудниками были сконструированы люминесцентные лампы «дневного света». Результаты своих исследований по изучению люминесценции и природы света С.И. Вавилов обобщил в монографии «Микроструктура света».
По продолжительности «послесвечения» люминесценция подразделяется на флуоресценцию и фосфоресценцию.
Флуоресценция – кратковременное свечение, прекращающееся почти сразу после прекращения облучения тела.
Фосфоресценция – свечение, продолжающееся еще некоторое время после облучения.
В настоящее время люминесценцией называют излучение, представляющее собой избыток над тепловым при данной температуре, длительность которого значительно превышает период световых волн (~10-15 с).
Это определение отличает люминесценцию от других видов свечения, таких, как отражение и рассеяние света, свечения, обусловленного тепловым движением атомов и молекул и др.
Вещества, обладающие ярко выраженной способностью люминесцировать, называются люминофорами.
В зависимости от способа возбуждения люминофора различают следующие виды люминесценции:
1. Фотолюминесценция возбуждается видимым и ультрафиолетовым излучением. Примером фотолюминесценции может служить свечение часового циферблата и стрелок, окрашенных соответствующим люминофором.
2. Рентгенолюминесценция возбуждается рентгеновскими лучами. Она наблюдается на экране рентгеновского аппарата.
3. Радиолюминесценция возбуждается радиоактивным излучением. Наблюдается на экранах сцинтилляционных счетчиков.
4. Катодолюминесценция возбуждается электронным лучом. Наблюдается на экранах телевизора, радиолокатора, осциллографа и других электоронно-лучевых приборов. В качестве люминофора, покрывающего экран, используются сульфиды и селениды цинка и кадмия.
5. Электролюминесценция возбуждается электрическим полем. Наблюдается в газоразрядных трубках.
6. Хемилюминесценция возбуждается химическими процессами в веществе. Например, свечение белого фосфора, гниющей древесины, а также свечение некоторых споровых растений, насекомых, морских животных и бактерий. К хемилюминесценции относят биолюминесценцию – видимое свечение организмов, связанное с процессами их жизнедеятельности. Слабая хемилюминесценция, сопровождающая свободнорадикальные, перекисные и другие процессы в биологических системах, используются для исследования биохимических и биофизических явлений. Этот метод, получивший название сверхслабых свечений, был развит в работах Ю.А. Владимирова.
Таким образом, люминесценция является своеобразным квантовым генератором, непосредственно преобразующим энергию ЭМВ различной длины волны, а также механическую, электрическую и химическую энергию в энергию видимого света.
Степень преобразования поглощаемой энергии E0 в энергию люминесценции E характеризуется энергетическим выходом люминесценции:
 (6)
(6)
Спектр люминесценции зависит от природы люминесцирующего вещества и вида люминесценции.
Из всех перечисленных видов подробнее рассмотрим фотолюминесценцию.
Фотолюминесценция. Закон Стокса
Фотолюминесценция подразделяется на флуоресценцию и фосфоресценцию.
Начальным актом любой фотолюминесценции является возбуждение фотоном с энергией  атома или молекулы.
атома или молекулы.
В наиболее простом случае, который обычно реализуется в одноатомных парах и газах, атом возвращается в основное состояние, излучая фотон света той же частоты  (рис. 4):
(рис. 4):

Это явление называют резонансной флуоресценцией (резонансным рассеянием).
Проведенные эксперименты показали, что такое свечение возникает приблизительно через 10-8 с после освещения вещества и поэтому не является рассеянием в обычном понимании этого слова.
При добавлении в люминесцирующие пары инородных газов (водород, кислород и др.) резонансная флуоресценция уменьшается.
Это происходит потому, что за время, пока атом находится в возбужденном состоянии, он может встретиться с молекулой другого сорта и отдать ей энергию. Кинетическая энергия молекулы при этом возрастает, а атом безызлучательно переходит в основное состояние.
Иная флуоресценция возникает, если переход из возбужденного состояния в основное происходит постепенно через промежуточные возбужденные состояния (рис. 5):

Энергия  как бы «разменивается» и излучаются фотоны с меньшими частотами.
как бы «разменивается» и излучаются фотоны с меньшими частотами.
В сложных органических молекулах возникает переход из возбужденного состояния в некоторое промежуточное, метастабильное, из которого переход в основное маловероятен. За счет молекулярно-кинетической энергии окружающих частиц возможно вновь возвращение молекулы на возбужденный уровень, а с него переход в основное состояние (рис. 6):
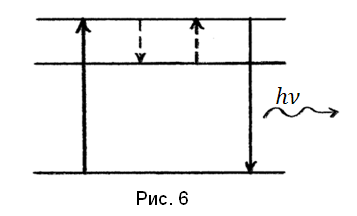
Таков один из механизмов фосфоресценции. Нагревание увеличивает вероятность ухода с метастабильного уровня и усиливает фосфоресценцию.
Экспериментальное изучение спектров фотолюминесценции показало, что они, как правило, отличаются от спектров возбуждающего излучения.
Закон Стокса: спектр люминесценции сдвинут в сторону длинных волн относительно спектра, вызвавшего эту фотолюминесценцию (рис.7):

Энергетический выход  люминесценции (6) может при некоторых условиях быть очень большим, достигающим 0,8. У жидких и твердых тел он зависит от длины волны возбуждающего света.
люминесценции (6) может при некоторых условиях быть очень большим, достигающим 0,8. У жидких и твердых тел он зависит от длины волны возбуждающего света.
Закон Вавилова: энергетический выход люминесценции сначала растет пропорционально длине волны возбуждающего света  , а затем, достигнув максимума, резко падает до нуля.
, а затем, достигнув максимума, резко падает до нуля.
На рисунке 8 приведен график зависимости  от λв, полученный С.И. Вавиловым для раствора флуоресцеина:
от λв, полученный С.И. Вавиловым для раствора флуоресцеина:
