Основные оксиды
1. Основный оксид + сильная кислота → соль + вода

2. Сильноосновный оксид + вода → гидроксид

3. Сильноосновный оксид + кислотный оксид → соль

4. Основный оксид + водород → металл + вода

Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота

Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль

3. Кислотный оксид + основание → соль + вода

Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:


4. Нелетучий оксид + соль1 → соль2 + летучий оксид

5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1

Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:

При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
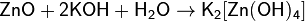 (в водном растворе)
(в водном растворе)
 (при сплавлении)
(при сплавлении)
Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:


При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:


2. Обжиг или горение бинарных соединений в кислороде:



3. Термическое разложение солей:


4. Термическое разложение оснований или кислот:
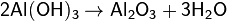

5. Окисление низших оксидов в высшие и восстановление высших в низшие:

6. Взаимодействие некоторых металлов с водой при высокой температуре:

7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:

8. Взаимодействие металлов с кислотами-окислителями:

9. При действии водоотнимающих веществ на кислоты и соли:

10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:

Основания
| .щёлочь + кислота | NaOH +HCl  NaCl + H2O Na+ + OH- + H+ + Cl- NaCl + H2O Na+ + OH- + H+ + Cl-  Na++ Cl- + H2O H+ +OH- Na++ Cl- + H2O H+ +OH-  H2O H2O
|
| 2.щёлочь + кислотный оксид | 2NaOH +CO2  Na2CO3 + H2O 2Na+ + 2OH- + CO2 Na2CO3 + H2O 2Na+ + 2OH- + CO2  2Na+ + CO32- + H2O 2OH- + CO2 2Na+ + CO32- + H2O 2OH- + CO2  CO32- + H2O CO32- + H2O
|
| 3.щёлочь + соль | 2NaOH +MgCl2  Mg(OH)2 Mg(OH)2  + 2NaCl 2Na+ + 2OH-+ Mg2++ 2Cl- + 2NaCl 2Na+ + 2OH-+ Mg2++ 2Cl-  Mg(OH)2 Mg(OH)2  +2 Na++2 Cl- 2OH-+ Mg2+ +2 Na++2 Cl- 2OH-+ Mg2+  Mg(OH) Mg(OH)
|
Кислоты
| 1.кислота + металл (стоящий до водорода в ЭХР напряжений) | 2HCl + Mg  MgCl2 + H2 MgCl2 + H2  2H+ + 2Cl- +Mg 2H+ + 2Cl- +Mg  Mg2+ + 2Cl- + H2 Mg2+ + 2Cl- + H2  2H+ + Mg 2H+ + Mg  Mg2+ + H2 Mg2+ + H2 
|
| 2.кислота + основный оксид | 2HCl + MgO  MgCl2 + H2O 2H+ + 2Cl- +MgO MgCl2 + H2O 2H+ + 2Cl- +MgO  Mg2+ + 2Cl-+ H2O 2H+ +MgO Mg2+ + 2Cl-+ H2O 2H+ +MgO  Mg2+ + H2O Mg2+ + H2O
|
| 3. кислота + основание | HCl + NaOH  NaCl + H2O H+ + Cl- + Na+ + OH- NaCl + H2O H+ + Cl- + Na+ + OH-  Na++ Cl- + H2O H+ +OH- Na++ Cl- + H2O H+ +OH-  H2O H2O
|
| 4. кислота + соль | HCl +AgNO3  AgCl AgCl 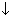 + HNO3 H+ + Cl- + Ag+ + NO3- + HNO3 H+ + Cl- + Ag+ + NO3-  AgCl AgCl 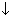 + H+ +NO3- Ag+ + Cl- + H+ +NO3- Ag+ + Cl-  AgCl AgCl 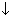
|
Соли
| 1.соль + металл | Fe + CuSO4  FeSO4 + Cu Fe + Cu2+ +SO42- FeSO4 + Cu Fe + Cu2+ +SO42-  Fe2++SO42- + Cu Fe + Cu2+ Fe2++SO42- + Cu Fe + Cu2+  Fe2++ Cu Fe2++ Cu
|
| 2.соль + щёлочь | (см. выше) |
| 3.соль + кислота | (см. выше) |
| 4.соль + соль | NaCl +AgNO3  AgCl AgCl 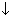 + NaNO3 Na+ + Cl- + Ag+ + NO3- + NaNO3 Na+ + Cl- + Ag+ + NO3-  AgCl AgCl 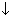 + Na + +NO3- Ag+ + Cl- + Na + +NO3- Ag+ + Cl-  AgCl AgCl 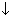
|
Галогенов
| .Взаимодействие с металлами | Mg + Cl2  MgCl2 MgCl2
|
| 2.Реакции с неметаллами | H2 + Cl2  2HCl 2HCl
|
| 3.Взаимодействие со щелочами на холоду | 2NaOH + Cl2  NaCl + NaClO + H2O NaCl + NaClO + H2O
|
| 4.Взаимодействие со щелочами при нагревании | 6NaOH + 3Cl2  5NaCl + NaClO3 + 3H2O 5NaCl + NaClO3 + 3H2O
|
| 5.Вытеснение менее активных галогенов из галогенидов | 2KBr + Cl2  2KCl + Br2 2KCl + Br2
|
| 6. С водой | H2O + Cl2  HCl + HClO(хлорная вода) HCl + HClO(хлорная вода)
|
N и P
Получение азота и фосфора.
| азот | фосфор |
| 1. В промышленности -фракционирование жидкого воздуха (tкип O2=-183 0C, N2=-196) 2. В лаборатории-разложение нитрита аммония при нагревании NH4NO2=N2+2H2O | 2Ca3(PO4)+10C+6SiO2=10CO+CaSiO3+P4 |
Химические свойства азота и фосфора.
| азота | фосфора |
| 1.Взаимодействие с кислородом | |
| N2+O2=2NO (эл.дуга, 3000 0C) | 4P+5O2=2P2O5 |
| 2. Взаимодействие с щелочными и щелочноземельными металлами 6Li+N2=2Li3N | 2.С галогенами 2P+5Cl5=2PCl5 |
3. С водородом 3N2+3H2  2NH3 2NH3
| 3.С активными металлами 2P+3Mg=Mg3P2 (фосфид) |
| 4. С сильными окислителями 3P+5HNO3+2H2O=3H3PO4+5NO |
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
| ХИМИЧЕСКИЕ СВОЙСТВА | |
| 1.С кислородом (Rb, Cs - самовоспламеняются) | 2Na+O2=Na2O2; 2K+2O2=K2O4 (пероксиды) 4Li+O2=2Li2O (оксид лития) |
| 2.С галогенами | 2Na+Cl2=2NaCl |
| 3.С серой при нагревании | 2Li+S=Li2S (сульфид) |
| 4.Литий взаимодействует с азотом | 6Li+N2=2Li3N (нитрид) |
| 5.С водородом при нагревании | 2Na+H2=2NaH (гидрид) |
| 6.С водой | 2Na+2H2O=2NaOH+H2 
|
БЕРИЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
| ХИМИЧЕСКИЕ СВОЙСТВА Сa и Mg (M = Сa, Mg) | |
| 1.С кислородом | 2M+O2=2MO |
| 2.С галогенами | M+Cl2=MCl2 |
| 3.С серой при нагревании | M+S=MS (сульфид) |
| 4.Литий взаимодействует с азотом | 3M+N2=M3N2 (нитрид) |
| 5.С водородом при нагревании | M+H2=MH2 (гидрид) |
| 6.С водой | M+2H2O=M(OH)2+H2 
|