Количество вещества тела (системы)
v=N/NA,
где N - число структурных элементов (молекул, атомов, ионов и т.п.), состав ляющих тело (систему);
NA - постоянная Авогадро (NA = 6,02 х 1023 моль-I).
Молярная масса вещества
Mr=m/n,
где m - масса однородного тела (системы);
n - количество вещества этого тела.
Относительная молекулярная масса вещества
Mr=åniAr,i,
где ni - число атомов i -го химического элемента, входящих в состав молекулы данного вещества;
Ar,i - относительная атомная масса этого элемента.
Относительные атомные массы приводятся в таблице Д. И. Менделеева.
Связь молярной массы M с относительной молекулярной массой вещества
M=Mrk,
где k = 10-3 кг/моль.
Количество вещества смеси газов
n=n 1 +n 2 +.....+nn = 
или 
где mi, ni, Ni Mi - соответственно масса, количество вещества, число молекул, молярная масса i- го компонента смеси.
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
pV= 
где р - давление газа;
V - объем газа;
m - масса газа;
М - молярная масса газа;
R - молекулярная газовая постоянная;
v - количество вещества;
Т - термодинамическая температура.
Эмпирические газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: Т = const, m=const)
pV=const
или для двух состояний газа
p1V1=p2V2;
б) закон Гей-Люссака (изобарный процесс: р=const, m=const)

или для двух состояний
 ;
;
в) закон Шарля (изохорный процесс: V=const m=const)

или для двух состояний
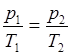 ;
;
г) объединенный газовый закон (m=const)

или для двух состояний
 ,
,
где р 1, V 1, T 1 - давление, объем и температура газа в начальном состоянии;
р 2, V 2, T 2 -те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов
p=p 1 +p 2 +...+pn,
где p 1- парциальные давления компонентов смеси;
n - число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью. Молярная масса смеси газов
M= 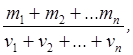
где mi - масса i -го компонента смеси;
vi= mi /Mi - количество вещества i -го компонента смеси;
n - число компонентов смеси.
Массовая доля i -го компонента смеси газа (в долях единицы или процентах)
wi= mi/m,
где m - масса смеси.
Концентрация молекул
n= 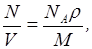
где N - число молекул, содержащихся в данной системе;
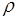 - плотность вещества;
- плотность вещества;
V - объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов
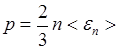 ,
,
где 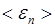 - средняя кинетическая энергия поступательного движения молеклы.
- средняя кинетическая энергия поступательного движения молеклы.
Средняя кинетическая энергия поступательного движения молекулы
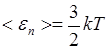 ,
,
где k - постоянная Больцмана.
Средняя полная кинетическая энергия молекулы

где i - число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры
p=nkT.
Скорости молекул:
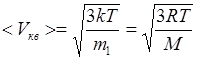 - средняя квадратичная;
- средняя квадратичная;
 - средняя арифметическая;
- средняя арифметическая;
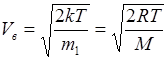 - наиболее вероятная,
- наиболее вероятная,
где m 1 - масса одной молекулы.
Удельные теплоемкости газа при постоянном объеме (cV) и постоянном давлении (cp)
cV= 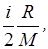 cp=
cp=  .
.
Связь между удельной c и молярной С теплоёмкостями
c=C/M.
Уравнение Майера для молярных теплоёмкостей
Cp-CV=R.
Внутренняя энергия идеального газа
U=  .
.
Первое начало термодинамики
Q=DU+A,
где Q - теплота, сообщенная системе (газу);
DU - изменение внутренней энергии системы;
А - работа, совершенная системой против внешних сил.
Работа расширения газа:
а) в общем случае A = 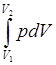 ;
;
б) при изобарном процессе A=p(V 2 -V 1 );
в) при изотермическом процессе A= 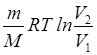 ;
;
г) при адиабатном процессе
A=  =
= 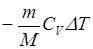 или A=
или A=  ,
,
где 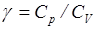 - показатель адиабаты.
- показатель адиабаты.
Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе
рVg=const, 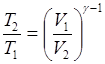 ,
, 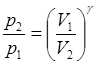 ,
, 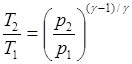 .
.
Термический КПД цикла
h= 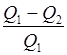 ,
,
где Q 1- теплота, полученная рабочим телом от теплоотдатчика,
Q 2- теплота, переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно
h= 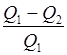 =
= 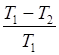 ,
,
где T 1 и T 2 - термодинамические температуры теплоотдатчика и теплоприемнка.
Коэффициент поверхностного натяжения
a=  или a=
или a= 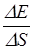 ,
,
где F - сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости;
DЕ - изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади DS поверхности этой пленки.
Формула Лапласа, выражающая давление р, создаваемое сферической поверхностью жидкости
p= 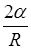 ,
,
где R - радиус сферической поверхности.
Высота подъема жидкости в капиллярной трубке
h = 
 ,
,
где q - краевой угол (q = 0 при полном смачивании стенок трубки жидкостью и q=p при полном несмачивании);
R - радиус канала трубки;
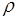 - плотность жидкости;
- плотность жидкости;
g - ускорение свободного падения.
Высота подъема жидкости между двумя близкими параллельными друг другу плоскостями
h = 
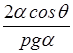 ,
,
где a - расстояние между плоскостями.