Амины – органические соединения, производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал. По числу атомов водорода в молекуле аммиака различают первичные (1), вторичные (2), и третичные (3) амины.
H H | | H – N–H H – N–CH3 или H3С – NH2 метиламин
Названия аминов обычно образуют от названий радикалов, входящих в молекулу, с добавлением окончания –амин.
Амины – это органические основания.
Большое значение имеют первичные амины, особенно фениламин или анилин C6H5NH2.
Анилин. Его получил Н.Н. Зинин в 1841 году из нитробензола. Как восстановитель М. М. Зинин использовал сульфид аммония:

Анилин можно рассматривать как производное бензола, в молекуле которого атом водорода замещен аминогруппой, или как производное аммиака, в молекуле которого один атом водорода замещен радикалом фенилом.
Структурная формула анилина такая:
 Анилин - бесцветная маслянистая жидкость со слабым характерным запахом. Он немного тяжелее воду и мало растворим в ней, но хорошо растворяется в спирте, эфире, бензоле. Ядовитый. На свойства анилина влияет бензольное ядро.
Анилин - бесцветная маслянистая жидкость со слабым характерным запахом. Он немного тяжелее воду и мало растворим в ней, но хорошо растворяется в спирте, эфире, бензоле. Ядовитый. На свойства анилина влияет бензольное ядро.
Электроны бензольного ядра, вступая во взаимодействие с неразделенной электронной парой азота, притягивают ее в свою сферу и оттягивают на себя. Как следствие этого на атоме азота уменьшается электронная плотность, слабее связывается протон и меньше образуется свободных гидроксильных ионов. Поэтому анилин проявляет очень слабые основные свойства (они выражены слабее, чем у аминов насыщенного ряда и аммиака). Например, раствор анилина не окрашивает лакмус в синий цвет, но при взаимодействии с сильными кислотами анилин образует соли (подобно аминов насыщенных).
Открытое М. М. Зининым превращения ароматических нитросоединений в амины дало начало новой эпохе в химической промышленности и стало толчком для бурного развития промышленности органического синтеза, особенно анилинокрасочной и фармацевтической промышленности.
«Если бы Зинин не сделал ничего более, кроме превращения нитробензола на анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии»,- так закончил свою речь, посвященную памяти Н. М. Зинина, в 1880 г. президент Немецкого химического общества, основатель немецкой анилинокрасочной промышленности А. В. Гофман.
Химические свойства.
Амины повторяют химические свойства аммиака, поскольку они е его производными.
Из – за взаимные влияния аминогруппы на радикал фенил, основные свойства анилина значительно слабее аммиака.
Так же, как и аммиак, амины взаимодействуют с кислотами, образуя соли.
Качественной реакцией на анилин является реакция с бромной водой.
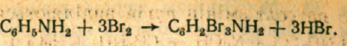
Полученная соль 2,4,6 триброманилин представляет собой белый осадок. Основное применение – производство красителей, также лекарств, полимеров.
Среди азотосодержащих органических веществ имеются соединения с двойственной функцией. Особенно важными из них являются аминокислоты.
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой. Аминокислоты, как правило, входят в состав полимеров - белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.).
Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
Физические свойства.
Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.