Теоретическая часть
Единицей измерения количества вещества является моль. Один моль - это такое количество вещества, которое содержит столько формульных единиц, сколько атомов содержится в 0,012кг изотопа углерода 12С. Число атомов в 12 граммах углерода 12С равно постоянной Авогадро, NА = 6.0221·1023моль-1. Массу одного моль вещества называют молярной массой. Основной единицей измерения молярной массы является килограмм на моль (кг/моль) или грамм на моль (г/моль). Например, молярная масса серной кислоты равна М(H2SO4)= 98г/моль. Кроме формулярных единиц в химии применяют такое понятие как эквивалент. Понятие эквивалента появилось после работ Рихтера (1793), открывшего закон эквивалентов. В некоторых химических реакциях, принимает участие не целая формульная единица, а лишь её часть, называемая эквивалентом.
1.1 Эквивалент – это реальная или условная частица вещества соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент - безразмерная величина. Эквивалент в ZB раз меньше, чем соответствующие ему реальные частицы и их формульные единицы. Число ZB называют эквивалентным числом или числом эквивалентности ZB ≥ 1. Обратную величину эквивалентного числа 1/ZB называют фактором эквивалентности (fЭ) В общем случае для некоторого вещества (B) 1/Z называют фактором эквивалентности, а Z числом эквивалентности. Число эквивалентности показывает сколько химических эквивалентов содержит одна формульная единица. Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента в данном соединении. Например, в соединениях: НСl, Н2О, NН3 и СН4, эквивалент хлора будет соответствовать 1 атому, кислорода - 1/2 атома, азота - 1/3 атома и углерода соответственно - 1/4 атома. Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ.
1.2 Молярная масса эквивалента вещества (М Э) – это такое количество вещества, которое соединяется с одним моль атомов водорода (1г) или замещает такое же количество в реакциях, выражается в грамм/моль. Она определяется как произведение молярной массы вещества на фактор эквивалентности.
Э = 1/ Zэкв М Э = М • f Э
1.3 Фактором эквивалентности для вещества называется число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H+ в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Эквивалент любого вещества можно рассчитать по формуле: Э = 1 ∙ fЭвещества .
Введение в химию понятия "эквивалент" позволило сформулировать закон эквивалентов. (Рихтер,1793г., Германия)
Закон эквивалентов: Массы реагирующих веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
 ;
; 
 = nэ
= nэ  = nЭ; nэ - количество эквивалентов,
= nЭ; nэ - количество эквивалентов,
МЭ - молярная масса эквивалента вещества, VЭ – Эквивалентный объём.
Для газообразных веществ удобно пользоваться эквивалентным объёмом.
1.5 Эквивалентный объём
Эквивалентным объемом(л/моль·экв, м3/моль·экв) называется объем, занимаемый при данных условиях (Р, Т) одним моль эквивалента вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что один моль любого газа занимает при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 22.4 литра, а эквивалентный объём (Vэ) будет занимать Vm•fэ данного газообразного вещества. Например, определим эквивалентный объём водорода. Поскольку один моль водорода состоит из двух моль атомов водорода, следовательно, в одном моль водорода содержится два эквивалента водорода; таким образом эквивалентный объем водорода будет равен 22.4/2 = 11.2 л/моль или 11.2 * 10-3 м3/моль.
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т. е. Vэкв (H) =11,2 л/моль
Аналогично можно рассчитать эквивалентный объём для кислорода, который будет равен:Vэкв (O2) = 5,6 л/моль.
1.6 Эквивалент и молярная масса эквивалента простых и сложных веществ.
Эквивалентом сложного вещества называется реальная или условная частица этого вещества, которая взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества
Для расчёта молярных масс эквивалентов простых и сложных веществ можно воспользоваться стационарными формулами:
Молярная масса эквивалента простого вещества(элемента) (мэ) определяется как частное от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении и измеряется в грамм/моль или граммах.
 ;
;  ; Э = 1·
; Э = 1·  ;
;  ;
;
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 грамм/моль•экв и 32/6 = 5.33 грамм/моль. Можно Mэвыражать в граммах.
Пример № 1. Определить эквивалент и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равную 19 г., кислорода – 16 • 1/2 = 8 г., азота – 14 * 1/3=4.67 г., углерода – 12 • 1/4=3 г.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2. Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ Мэ ме = mСl/ Мэ Сl, т.е.
20.22/ Мэ ме = 79,78/35.45 => Мэ ме=20.22•35.45/79.78=8.98 г. Молярная масса эквивалента металла равна 8.99 г.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:
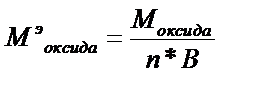 ;
;  ;
; 
где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3. Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Мэ FeO = 72/(2*1) = 36 (г/моль); Мэ Fe2O3=159.6/(2*3) = 26.6 (г/моль);
Мэ FeO3= 103.8/(6*1) = 16.3 (г/моль)
Молярные массы эквивалентов кислот в реакциях обмена:
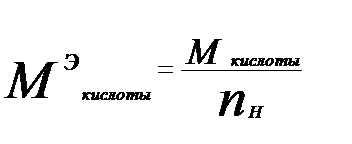 ;
; 
где Мкислоты – молярная масса кислоты; nн –(основность), число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4. Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
1) H3PO4 + 3KOH = K3PO4 + 3H2О;
2) H3PO4 + 2KOH = K2HPO4 + 2H2О;
3) H3PO4 + KOH = KH2PO4 + H2О;
Решение. Молярная масса H3PO4 равна 98 г/моль. В реакции (1) количество nн атомов водорода, заместившихся на металл, равны 3(кислота проявляет основность равную трём), следовательно эквивалентом Н3Р04 будет являться условная частица 1/3 молекулы H3PO4, т.к. если одна молекула H3PO4 предоставляет три иона Н+, то один ион Н+ дает 1/3 молекулы H3PO4.,. С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает 3 иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/3 молекулы кислоты. Эквивалентом кислоты является условная частица 1/3Н3РО4, а эквивалентом щелочи частица КОН, Mэ (H3PO4)= 98/3 =32,7 г/моль•экв, fэ (H3PO4) = 1
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса Mэ(H3PO4) = 98/2 = 49 г/моль, fэ (H3PO4) = 1|2
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса M Э= 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:
 ;
; 
где Mоснования – молярная масса основания; nон – число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток (кислотность).
Пример № 5. Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
1) Сu(ОН)2 + 2HCl = CuCl2 + 2H2O;
2) Сu(ОН)2 + HCl = CuOHCl + H2O;
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента МэСu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Молярные массы эквивалентов оснований солей в реакциях обмена:
 ;
; 
где Мсоли – молярная масса соли; – число атомов металла; – валентность (степень окисления) металла.
Пример № 6. Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, МэAl2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление
 ;
; 
где МOx-Red – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7. Чему равна молярная масса эквивалентна и фактор эквивалентности перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается:
1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Решение. 1) При восстановлении KMnO4 до MnSO4 степень окисления марганца понизится с +7 до +2, т.е. число электронов, идущих на восстановление, равно 5. Следовательно,
МэKMnO4 = MKMnO4/5 = 158/5 = 31.6 (г/моль). fЭ = 1/5
2) При восстановлении KMnO4 до MnO2 степень окисления марганца понизится с +7 до +4, т.е. число электронов, идущих на восстановление, равно 3. Следовательно,
МэKMnO4 = MKMnO4/3 = 158/3 = 52.66 (г/моль). fЭ = 1/3
3) При восстановлении KMnO4 до K2MnO4 степень окисления марганца понизится с +7 до +6, т.е. число электронов, идущих на восстановление, равно 1. Следовательно,
МэKMnO4 = MKMnO4/1 = 158/1 = 158 (г/моль). fЭ = 1
Для решения задач удобно пользоваться аддитивными формулами, т.е. молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов его составных частей, например:
М Э(оксида) = М Э(элемента) + М Э(О) = М Э(элемента) + 8
М Э(кислоты) = М Э(Н+) + М Э(кислотного остатка) = 1 + М Э кислотного остатка
М Э(основания) = М Э(Ме) + М Э(ОН-) = М Э(Ме) + 17
М Э(соли) = М Э(Ме) + М Э кислотного остатка
 ;
;  MэOH- = 17г.
MэOH- = 17г.
Выполнение работы