Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа.
Всякое изменение состояния газа называется термодинамическим процессом.
Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами.
Изопроцессы являются идеализированной моделью реального процесса в газе.
Изопроцессы подчиняются газовым законам.
Газовые законы определяют количественные зависимости между двумя параметрами газа при неизменном значении третьего.
Газовые законы справедливы для любых газов и газовых смесей.
ОСНОВНЫЕ ФОРМУЛИРОВКИ ГАЗОВЫХ ЗАКОНОВ:
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:

Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:

Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
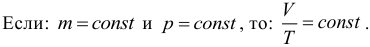
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
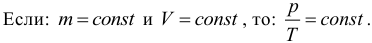
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
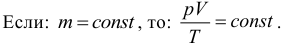
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
ПОЯСНЕНИЯ К ГАЗОВЫМ ЗАКОНАМ
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре.
Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта:
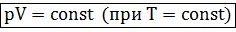
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Объясним этот процесс с точки зрения молекулярно – кинетической теории: при разрежении газа, то есть увеличении объема, молекулы располагаются дальше друг от друга, уменьшается их концентрация в сосуде. Поэтому они реже ударяют о стенки сосуда, и от этого давление газа уменьшается. А при сжатии газа, то есть уменьшении его объема, молекулы располагаются ближе друг к другу, увеличивается их концентрация в сосуде. Поэтому они чаще ударяют о стенки сосуда, и от этого давление газа увеличивается.
Формулу закона можно записать иначе
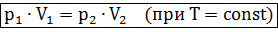
где
 – параметры газа в разные моменты времени
– параметры газа в разные моменты времени
Графическое представление изотермического процесса:
Графики изотермического процесса в координатах р – V; р – Т и V – Т имеют следующий вид:
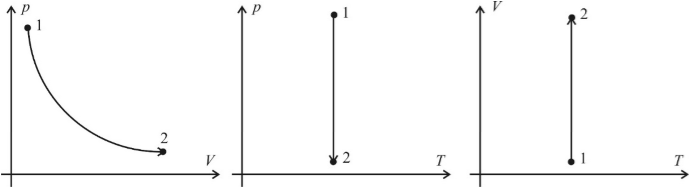
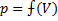 - график, отражающий изотермический процесс, называется изотермой.
- график, отражающий изотермический процесс, называется изотермой.
(математически – это гипербола)
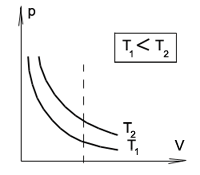
На графиках представлены изотермы для разных температур газа, где Т1 меньше Т2.
Изобарный процесс (p =const)
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении.
Изобарный процесс в идеальном газе подчиняется закону Гей-Люсака:

Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется.
Объясним этот процесс с точки зрения молекулярно – кинетической теории: при нагревании газа увеличивается скорость движения молекул, которые при столкновении друг с другом разлетаются на большие расстояния, то есть происходит увеличение объема газа, а при охлаждении – понижении температуры, уменьшается скорость движения молекул, что приводит к уменьшению расстояния между молекулами, так как они уже не могут разлетаться на большие расстояния и объем газа уменьшается.
Формулу закона можно записать иначе
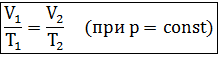
где
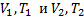 – параметры газа в разные моменты времени
– параметры газа в разные моменты времени
Графическое представление изобарного процесса:
Графики изобарического процесса в координатах р – V; V – Т и р – Т имеют следующий вид:

Обратите внимание на то, что продолжение графика в V – T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
 - график, отражающий изобарный процесс, называется изобарой.
- график, отражающий изобарный процесс, называется изобарой.
(математически – это линейная зависимость)
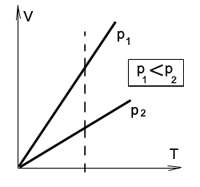
На графиках представлены изобары для разных давлений газа, где р1 меньше р2.
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме.
Изохорный процесс в идеальном газе подчиняется закону Шарля:
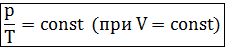
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется.
Объясним этот процесс с точки зрения молекулярно – кинетической теории: при нагревании газа увеличивается скорость движения молекул, которые сильнее ударяют о стенки сосуда, что приводит к увеличению давления. А при охлаждении скорость движения молекул уменьшается, следовательно они реже и слабее ударяют о стенки сосуда, что приводит к уменьшению давления.
Формулу закона можно записать иначе
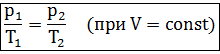
где
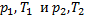 – параметры газа в разные моменты времени
– параметры газа в разные моменты времени
Графическое представление изохорного процесса:
Графики изохорного процесса в координатах р – V; р – Т и V – Т имеют следующий вид:

Обратите внимание на то, что продолжение графика в p – T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
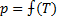 - график, отражающий изохорный процесс, называется изохорой.
- график, отражающий изохорный процесс, называется изохорой.
(математически – это линейная зависимость)
Задания:
Задание 1. Провести анализ отдельных газовых процессов, представленных на диаграмме (точками указаны состояния; направления процессов на графике указаны стрелками).
Для этого используем алгоритм анализа газовых процессов:
1. Дать название процесса.
2. Дать название графика процесса.
3. Указать закон, которому подчиняются параметры идеального газа в данном процессе.
4. Описать изменения основных параметров газа p,V,T в ходе процесса.
Анализ
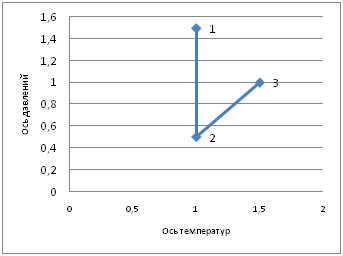
Участок 1-2:
1. Т.к. Т1=Т2, а p2<p1, то из уравнения Бойля-Мариотта следует, что если p убывает, то V увеличивается. Значит, процесс 1-2 называют изотермическим расширением газа, T=const.
2. Линия 1-2 изотерма.
3. Закон Бойля-Мариотта.
4. Т.к. p2<p1,т.е. давление уменьшается, то в соответствии с законом Бойля-Мариотта V увеличивается (V2>V1).
Участок 2-3:
1. Т.к. Т3>T2, т. е. Т увеличивается и p3>p2, т. е. p увеличивается, то из уравнения Шарля следует, что p~T при V=const, значит, процесс 2-3 является изохорным нагреванием.
2. Линия 2-3 изохора.
3. Закон Шарля.
4. Т.к. Т3>T2, т. е. Т увеличивается, то в соответствии с законом Шарля давление газа увеличивается p3>p2.
Задание 2: Провести анализ процессов, изображенных на диаграмме
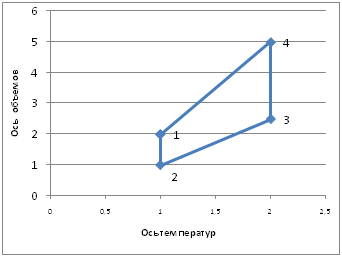
Участок 1-2:
1. Изотермическое сжатие, Т=const.
2. Линия 1-2 изотерма.
3. Закон Бойля-Мариотта: pV=const (p ~1/V).
4. Т.к. V2<V1, т. е. V уменьшается, то p увеличивается(p2>p1).
Участок 2-3:
1. Изобарное нагревание, p=const, p2=p3.
2. Линия 2-3 изобара.
3. Закон Гей-Люссака: V/T=const, V~T.
4. Т.к. Т3>Т2 , т.е. Т увеличивается, то V увеличивается(V3>V2).
Участок 3-4:
1. Изотермическое расширение, Т=const, Т3=Т4.
2. Линия 3-4 изотерма.
3. Закон Бойля-Мариотта: pV=const (p~1/V).
4. Т.к. V3<V4, т. е. V увеличивается, то p уменьшается (p3>p4).
Участок 4-1:
1. Изобарное охлаждение, p=const, p1=p4.
2. Линия 4-1 изобара.
3. Закон Гей-Люссака: V/T=const, V~T.
4. Т.к. Т1 <Т4, т.е. Т уменьшается, то V уменьшается, т.е. (V1<V4).
Задание 3. Баллон вместимостью V1 = 0,02 м3, содержавший воздух под давлением p1 = 4 * 105 Па, соединяют с баллоном вместимостью V2= 0,06 м3, из которого воздух выкачан. Найти давление p, установившееся в сосудах. Температура постоянна.
Решение. Воздух из первого баллона займет весь предоставленный ему объем V1 + V2. По закону Бойля-Мариотта
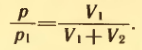
Отсюда искомое давление равно:
