Буферные системы
Функциональное состояние живых организмов неразрывно связа-но с постоянством активной реакции среды тканей, органов и ряда биологических жидкостей (крови, слюны, желудочного сока и др.), определяемой водородным показателем (рН). Состояние кислотно-основного равновесия, соответствующее норме, называется протоли-тический гомеостаз. Смещение протолитического равновесия в кис-лую область (снижение рН) вызывает ацидоз, в щелочную (повыше-ние рН) - алкалоз. Возникновение этих отклонений может быть выз-вано разными причинами.
Например, в процессе метаболических превращений в клетках организма образуются кислоты (угольная, серная, фосфорная, молочная и др.) и основания (аммиак, азотистые основания). Выделе-ние этих веществ в количествах, превышающих допустимую норму, может привести к ацидозу или алкалозу.
В процессе тканевого дыхания в организме высвобождается большое количество углекислого газа. Транспорт СО2 осуществля-ется кровью, которая представляет собой одну из важнейших внут-ренних сред организма и характеризуется определенным диапазоном колебаний рН – от 7,37 до 7,45 со средней величиной 7,38-7,40. Даже небольшие отклонения рН крови от нормы свидетельствуют о патологических нарушениях метаболизма. Величины рН крови ниже 6,8 и выше 7,8 несовместимы с жизнью.
Присутствие кислотных оксидов (таких как СО2) может вызвать сдвиг значений рН раствора в область более низких значений, что в данном случае может привести к серьезным физиологическим нару-шениям. Действительно, вопреки распространенному мнению, дли-тельное пребывание человека в замкнутом пространстве приводит к удушью и гибели не из-за недостатка кислорода, а из-за избытка СО2.
Однако, присутствие в крови допустимых концентраций кислот, оснований или углекислого газа не вызывает нарушений кислотно-основного гомеостаза. Это означает, что в организме присутствуют системы, способные поддерживать концентрацию ионов водорода на заданном уровне. Таких систем в организме человека три: дыхатель-ная система (легкие), выделительная система (почки) и комплекс буферных систем.
Действительно, от кислотных оксидов (CO2) организм освобож-дается благодаря процессу дыхания, а нелетучие кислоты и основа-ния выводятся через почки с мочевыведением. Однако эти физиоло-гические процессы протекают медленно, быстрая же нейтрализация этих веществ и поддержание постоянства pH в норме осуществляется за счет физико-химических процессов, среди которых главная роль принадлежит протолитическим равновесиям в буферных системах биологических сред организма.
Типы буферных систем
Буферные системы (буферы) – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему некоторого количества сильной кислоты или щелочи. Эта способность буферных систем называется буфер-ным действием. Растворы, содержащие одну или несколько буфер-ных систем называются буферными растворами. Интервал значений рН, в котором система проявляет буферные свойства, называется зоной буферного действия.
Буферные растворы применяются для сохранения активной реакции среды на определенном уровне, если тот или иной процесс (например, выращивание культуры бактерий, проведение фермента-тивной реакции и т.п.) должен быть проведен при постоянном значении рН.
Буферные системы могут быть двух типов. Некоторые примеры буферных систем и их характеристики приведены в таблице 1.
В биологических объектах буферные системы могут быть также образованы из ионов и молекул амфолитов, например, аминокислот-ные и белковые буферные системы.
В водных растворах a-аминокислоты присутствуют в виде равно-весной смеси биполярного иона, катионной и анионной форм:
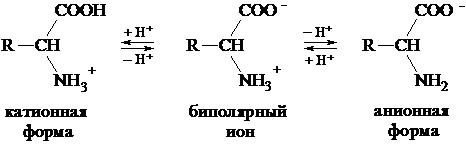
Таблица 1. Типы буферных систем.
| I. Слабая кислота и ее анион НА/А- | |||
| Название | Состав | Протолитическое равновесие | Зона буферного действия |
| Ацетатная | СН3СООН и CH3COONa | СН3СООН ⇄ CH3COO- + H+ | рН = 3,8 - 5,8 |
| Гидрокарбонатная | Н2СО3 и NaНСО3 | Н2СО3 ⇄ НСО3- + H+ | рН = 5,4 - 7,4 |
| Фосфатная | NaH2PO4 и Na2HPO4 | H2PO4– ⇄ HPO42- + H+ | рН = 6,2 - 8,2 |
| Гемоглобиновая | HHb и KHb | HHb ⇄ Hb- + H+ | рН = 7,2 - 9,2 |
| Оксигемоглобиновая | HHbO2 и KHbO2 | HHbO2 ⇄ HbO2- + H+ | рН = 6,0 - 8,0 |
| II. Слабое основание и его катион В/ВН+ | |||
| Аммонийная | NH3×H2O и NH4Cl | NH3 + H+ ⇄ NH4+ | рН = 8,2 - 10,2 |
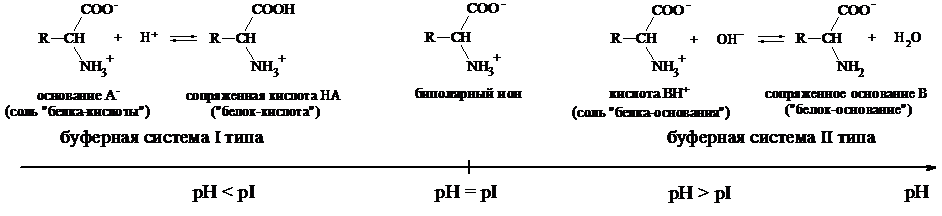 Рис.1. Буферные системы на основе амфолитов.
Рис.1. Буферные системы на основе амфолитов.
Соотношение между этими формами зависит от pH среды. В сильнокислых средах (pH = 1-2) преобладают катионные формы, в сильнощелочных (pH = 13-14) - анионные.
Полностью протонированная a-аминокислота (катионная форма), не содержащая ионогенных групп в радикале, с позиций теории Бренстеда является двухосновной кислотой, диссоциация которой описывается при помощи двух констант:  характеризует диссоци-ацию карбоксильной группы,
характеризует диссоци-ацию карбоксильной группы,  - протонированной аминогруппы.
- протонированной аминогруппы.
Значение pH, соответствующее наибольшей концентрации бипо-лярного иона, называется изоэлектрической точкой (pI). В общем случае величину pI вычисляют по формуле:
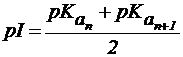 , ,
| (1) |
где n - максимальное число положительных зарядов в полностью протонированной форме.
Для аминокислот, не содержащих ионогенных групп в радикале, величину pI вычисляют по формуле:

| (2) |
Пример 1. Рассчитать величину pI аргинина, если для этой a-аминокислоты:  = 2,2;
= 2,2;  = 9,0;
= 9,0; 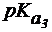 = 12,6.
= 12,6.
Решение.
Полностью протонированная форма аргинина выглядит так:

Видно, что n = 2. Поэтому:

Растворы аминокислот с pH = pI не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. При этом образуется смесь двух форм белка - «белок-кислота» и «белок-основание» (рис.1). Из рис. 1. видно, что при pH < pI растворы белков и аминокислот могут проявлять свойства буферных систем I типа, а при pH > pI - II типа.
Механизм буферного действия
С точки зрения протолитической теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
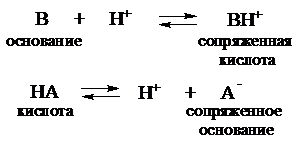
Сопряженные кислотно-основные пары А-/НА и В/ВН+ состав-ляют буферные системы.
Рассмотрим механизм буферного действия буферной системы на примере раствора, содержащего CH3COONa и СН3СООН. Уксусная кислота - слабый электролит, частично диссоциирующий на ионы:
СН3СООH ⇄ СН3СООН + H+
Ацетат натрия - сильный электролит, полностью распадающийся на ионы:
СН3СООNa  СН3СОО- + Na+
СН3СОО- + Na+
При добавлении сильной кислоты (например, НСl) сопряженное основание СН3СОО- связывает ионы Н+ в молекулы слабой кислоты:
СН3СОО- + H+  СН3СООН
СН3СООН
Таким образом, концентрация свободных ионов Н+ в растворе, а следовательно, и величина рН практически не изменяется.
Следует отметить, что при этом в буферной системе снижается концентрация анионов СН3СОО- и повышается концентрация моле-кул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли и, как следст-вие, наблюдается незначительное изменение рН. Существенные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования анионов СН3СОО-.
При добавлении сильной щелочи (например, КОН) усиливается диссоциация уксусной кислоты, поскольку выделяющиеся в раствор ионы Н+ реагируют с ионами ОН-, образуя воду:
СН3СООH + OH-  СН3СОО- + H2O
СН3СОО- + H2O
В этом случае также не происходит существенного изменения концентрации ионов Н+ в растворе, поскольку добавленные ионы ОН- оказываются связанными в молекулы слабого электролита - воды, но небольшое изменение в соотношении концентраций слабой кислоты и ее соли (уменьшение концентрации СН3СООН и увеличе-ние концентрации СН3СОО-) приводит к незначительному повыше-нию рН. Значительные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования молекул кислоты.
Рассмотренные случаи показывают, что каждый компонент буферного раствора выполняет строго определенную функцию: за нейтрализацию добавленной кислоты «отвечают» анионы соли, а за нейтрализацию добавленной щелочи – молекулы кислоты.
Таким образом, для буферных растворов I типа справедливы заключения:
Чем больше концентрация соли, тем большее количество кис-лоты можно добавлять к буферу без существенного понижения рН.
Чем больше концентрация кислоты, тем большее количество щелочи можно добавлять к буферу без существенного повышения рН.
Механизм действия буферных систем II типа рассмотрим на примере раствора, содержащего аммиак и хлорид аммония.
В водном растворе гидратная форма аммиака проявляет свойства частично распадающегося на ионы слабого основания, тогда как хлорид аммония является сильным электролитом, полностью диссо-циирующим на ионы:
NH3∙H2O ⇄ NH4+ + OH-
NH4Сl  NH4+ + Cl-
NH4+ + Cl-
При добавлении сильной кислоты введенные в раствор ионы Н+ реагируют с ионами ОН-, образуя воду. При этом равновесие диссо-циации слабого основания смещается вправо, и в раствор переходит дополнительное количество ионов ОН-, компенсируя их затрату на реакцию. Поэтому значительного изменения рН не происходит, хотя из-за изменения соотношения между концентрациями основания и катиона наблюдается небольшое снижение рН.
При добавлении сильного основания равновесие диссоциации аммиака смещается влево, и добавленные в раствор ионы ОН- оказы-ваются связанными в молекулы присутствующими в растворе катионами NH4+, поэтому существенного отклонения рН не происхо-дит. Небольшое повышение рН связано с изменением соотношения между молекулами аммиака и катионами аммония в растворе.
Эти процессы описываются уравнениями:
NH3∙H2O + Н+  NH4+ + H2О;
NH4+ + H2О;
NH4+ + ОН- ⇄ NH3∙H2O,
из которых видно, что в буферной системе II типа каждый компонент также играет определенную роль: за нейтрализацию добавленной кислоты «отвечает» слабое основание, тогда как за нейтрализацию добавленной щелочи отвечает соль, создающая в растворе значитель-ную концентрацию катионов.
Таким образом, для буферных систем II типа можно заключить:
Чем больше концентрация слабого основания, тем большее коли-чество кислоты можно добавить к буферу без существенного снижения рН.
Чем больше концентрация соли, тем большее количество щелочи можно добавить к буферу без существенного повышения рН.
Значительное изменение рН буферного раствора произойдет только в том случае, когда большая часть одного или другого компо-нента раствора (более 90%) будет израсходована на связывание добавленных ионов в молекулы.
На основании приведенных примеров механизм буферного действия в общем случае можно определить следующим образом:
Буферное действие осуществляется за счет связывания добав-ляемых в раствор ионов Н+ или ОН - в малодиссоциированные соеди-нения в результате реакций этих ионов с соответствующими компонентами буферной системы.