равенство М = J*B, где J - главный момент инерции тела (момент инерции относительно главной оси)
9. Момент импульса тела и системы тел. Закон сохранения момента импульса, примеры.
Момент импульса (количества движения) материальной точки А относительно неподвижной точки О называется физическая величина, определяемая векторным произведением
Моментом импульса относительно неподвижной оси z называется скалярная величина L,, равная проекции на эту ось вектора момента импульса, определенного относительно произвольной точки О данной оси. Значение момента импульса Lz независит от положения точки О на оси z.
 При вращении абсолютно твердого тела вокруг неподвижной оси каждая точка тела движется по окружности постоянного радиуса rt со скоростью £5; перпендикулярной радиусу. Момент импульса отдельной частицы равен Liz= mirivi и направлен по оси в сторону, определяемую правилом правого винта (совпадает с направлением вектора угловой скорости w).
При вращении абсолютно твердого тела вокруг неподвижной оси каждая точка тела движется по окружности постоянного радиуса rt со скоростью £5; перпендикулярной радиусу. Момент импульса отдельной частицы равен Liz= mirivi и направлен по оси в сторону, определяемую правилом правого винта (совпадает с направлением вектора угловой скорости w).
Момент импульса твердого тела относительно оси есть сумма моментов импульса отдельных частиц:
Lz= 
Продифференцируем по времени
dJz\dt=Jz(dw\dt)=JzB=Mz
В векторной форме: M=(dL\dt=L(с одной точкой) – ещё одна форма динамики вращательного движения твердого тела.
В замкнутой системе момент внешних сил М = 0, следовательно, и L = 0.
Закон сохранения момента импульса: момент импульса замкнутой системы сохраняется, т.е. не изменяется с const течением времени:
L=const
Это - фундаментальный закон природы. Он является следствием изотропности пространдтва: инвариантность физических законов относительно выбора направления осей координат системы отсчета.
При равномерном вращении твердого тела относительно некоторой оси z закон сохранения момента импульса L =const равносилен: J2w = const
10. Модель идеального газа. Давление и температура как статистические параметры.
Физическая модель, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с
объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда
абсолютно упругие.
Исходя из этого идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
Законы, описывающие поведение идеальных газов - законы Бойля-Мариотта, Авогадро, Дальтона, Гей-Люссака,
Температура - одно из основных понятий, играющих важнейшую роль в физике в целом.
Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
В настоящее время используют две температурные шкалы.
Международная практическая шкала (шкала Цельсия ) градуированная в градусах Цельсия (°С) по двум реперным точкам - температурам замерзаний и кипения воды при давлении 1,013-Ю5 Па, которые принимаются соответственно 0°С и 100°С.
Термодинамическая температу рная шкала, (шкала,,, Кельвина!, градуированная в градусах Кельвина (К) определяется по одной реперной точке - тройной точке воды - температуре, при которой лед, вода и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии, Температура этой точки по данной шкале равна 273,16 К. Температура Т = 0 К называется нулем Кельвина.
Термодинамическая температура (Г) и температура (t) по Международной практической шкале связаны соотношением
Т = 273,15 + t
Нормальные условия: То = 273,1.5 К = 0° С,
р0 = 101325 Па.
12. Чисто степеней свободы и средняя энергия теплового движения молекулы.
Внутренняя энергия идеального газа.
| Число степеней свободы | Одноатомный газ | Двухатомный газ |  Многоатомный газ Многоатомный газ
| |
  
|   
|  
| ||
| Поступательных | ||||
| Вращательных | — | |||
| Всего | ||||
Число степеней свободы - это число независимых переменных, полностью определяющих положение системы в пространстве.
В реальных молекулах нет жесткой связи между атомами в молекуле, поэтому необходимо учитывать также степени свободы колебательного движения атомов внутри молекулы.
Независимо от общего числа степеней свободы молекулы, три степени свободы всегда поступательные, На каждую из них приходится треть кинетической энергии поступательного движения молекулы (е0)
(е1)= ((е0)\3)=(3\2kT)\3=1\2kT)
Для системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия, равная кТ/2, а на каждую
колебательную степень свободы - в среднем энергия, равная кТ.
Энергия колебательных степеней свободы вдвое больше, поскольку колебательная система обладает равными по величине средними значениями как кинетической, так и потенциальной энергии.
Таким образом, средняя энергия молекулы (в) = (e)=i\2\кТ, где i - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпост + iвращ + 2* iколе6.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них / совпадает с числом степеней свободы молекулы.
В идеальном газе молекулы между собой не взаимодействуют и их потенциальная энергия равна нулю. Поэтому внутренняя энергия одного моля идеального газа Un и произвольной массы т газа U будут соответственно
U  =(e)Na=i\2kTNa=i\2RT
=(e)Na=i\2kTNa=i\2RT
U=(mi\  2)RT=v(i\2)RT
2)RT=v(i\2)RT
| Изотермы Адиабаты |
 16. Круговой процесс. Его применение в тепловой и холодильной машинах. КПД тепловой машины.
16. Круговой процесс. Его применение в тепловой и холодильной машинах. КПД тепловой машины.

Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние, На (p,V)-диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 -сжатию газа.
Работа расширения А] (площадь фигуры1a2V2V11) положительна: А1 >0.
Работа сжатия А2 (площадь фигуры 2b1V1V22) отрицательна: A 2<0.
Работа за цикл А определяется площадью, охватываемой замкнутой кривой;
А = А}+А2
Таким образом, работа - это функция, не только состояния термодинамической системы, но и вида процесса, который происходит. Поэтому работа не является однозначной функцией состояния (такой, как внутренняя энергия). Из первого начала термодинамики следует, что теплота Q, так же как и работа А, является функцией процесса, который происходит с системой.
Цикл называется прямым, если за цикл совершается положительная работа А = Q pdV > 0 (цикл протекает по часовой стрелке - рисунок (А)). V
Цикл называется обратным, если за цикл совершается отрицательная работа A = QpdV <0 (цикл протекает против часовой стрелки - рисунок (Б)),
Прямой цикл используется в тепловых двигателях (совершают работу за счет полученной извне теплоты). Обратный цикл используется в холодильных машинах
(за счет работы внешних сил теплота переносится к телу с более высокой температурой).
В результате кругового процесса система возвращается в исходное состояние, следовательно, полное изменение внутренней энергии равно нулю. Поэтому Q - A.U + А = А, т.е.
работа, совершаемая за цикл, равна количеству >'
полученной извне теплоты. Если в ходе кругового процесса система не только |
получает количество теплоты Q1, но и теряет (отдает) количество теплоты Q2, Q=Q1-Q2 f
Термический коэффициент полезного действия для кругового процесса - это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой:
n=A\Q1=Q1-Q2\Q7=1-Q2\Q1
17. Цикл Карно. его КПД.
Наиболее экономичный обратимый круговой процесс, состоящий из двух изотерм и двух адиабат.
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Последовательные термодинамические процессы в цикле Карно 1-ичотерма -2-адиабата-3-изотерма-4- адиабата-1:
| Изотермическое расширение 1—2 T = const; V2 > V1 | A12=m\  RT1InV2\V1=Q1 RT1InV2\V1=Q1
|
| Адиабатическое расширение 2—3 δQ = 0; Т2<Т1 | A23=-m\  (T2-T1) (T2-T1)
|
| Изотермическое сжатие 3—4 Т = const, V4 < V3 | A34=m\  RT2InV4\V3= -Q2 RT2InV4\V3= -Q2
|
 Адиабатическое сжатие Qδ = O; Т1>Т2 Адиабатическое сжатие Qδ = O; Т1>Т2
| A41= -m\  Cv(T1-T2)= = - A23 Cv(T1-T2)= = - A23
|
Работа, совершаемая в результате кругового процесса
A= A12 + A23 + A34 + A41= Q1+ A23 –Q2 + A23 =Q1-Q2
Для адиабат 2-3 и 4-1 уравнения Пуассона T1  = T2
= T2 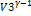
T1  = T2
= T2  , откуда V1\V2=V3\V4
, откуда V1\V2=V3\V4
Используя это, термический КПД цикла Карно
n=(Q1-Q2)\Q1= ((m\  )RT1In(V2-V1)-(m\
)RT1In(V2-V1)-(m\  )RT2In(V3\V4))\(m\
)RT2In(V3\V4))\(m\  )RT1In(V2-V1)=T1-T2\T1
)RT1In(V2-V1)=T1-T2\T1
действительно определяется только температурами нагревателя и холодильника.
Теорема Карно
Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей T1и холодильников Т2, наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
17. Адиабатный процесс, его уравнение.
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающей средой (50 = 0).
К адиабатическим процессам можно отнести все быстропротекающие процессы (теплообмен не успевает совершиться), например, распространение звука в среде, циклы расширения и сжатия в двигателях внутреннего сгорания, в холодильных установках и т. д.
Из первого начала термодинамики следует, что при адиабатическом процессе δA=-dU. Используя δA=pdV и dU=m\  CvdT, получим pdV=-m\
CvdT, получим pdV=-m\  CvdT(1). С другой стороны, из pV= m\
CvdT(1). С другой стороны, из pV= m\  RT следует pdV+Vdp= m\
RT следует pdV+Vdp= m\  RdT(2).
RdT(2).
Разделив (2) и (1) получим
pdV+Vdp\pdV=-r\Cv=-Cр-Cv\Cv или dp\p=-  , где
, где 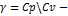 коэффицент Пауссона. Интегрирование этого уравнения дает InV^
коэффицент Пауссона. Интегрирование этого уравнения дает InV^  +Inp=Inconst, откуда следует уравнение Пауссона – уравнение адиабатического процесса. pV^
+Inp=Inconst, откуда следует уравнение Пауссона – уравнение адиабатического процесса. pV^  =const
=const
Используя уравнение Менделеева-Клайперона pV=m\  RT, получаем:
RT, получаем:
TV^  -1-
-1-  =const
=const
T^  p^1-
p^1-  =const
=const
Диаграмма адиабатического процесса- адиабата – в координатах (p,V) изображается гиперболой. Адиабата (pV^  =const) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увелечение давления газа обусловлено не только уменьшением его объема, но и повышение температуры.
=const) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увелечение давления газа обусловлено не только уменьшением его объема, но и повышение температуры.

18. Второе начало термодинамики, его формулировки. Энтропия, ее статистический
смысл
Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие - нет.
Существуют ещё две Формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным
результатом которого является превращение теплоты, полученной
от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным
результатом которого является передача теплоты от менее
нагретого тела к телу более нагретому,
Количество тепла  Q, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (
Q, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (  Q не является функцией состояния системы).
Q не является функцией состояния системы).
Однако, приведенное количество теплоты - отношение теплоты  Q к температуре Т системы при бесконечно малых изменениях состояния системы - есть функция состояния системы. В любом обратимом круговом процессе
Q к температуре Т системы при бесконечно малых изменениях состояния системы - есть функция состояния системы. В любом обратимом круговом процессе
 Q\T=0
Q\T=0
Следовательно, подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только начальным и конечным состояниями системы и не зависит от пути, каким система пришла в это состояние.
Энтропией S называется функция состояния системы, дифференциалом которой является  Q/T:
Q/T:
ds= 
Т.о. первое начало термодинамики 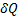 =dU+
=dU+  можно записать в виде Tds=dU+
можно записать в виде Tds=dU+  откуда
откуда 
Функция F=U-TS является функцией состояния системы и называется энергией Гельмгольца или свободной энергией.
14. Теплоемкости идеального газа при постоянном объеме и при постоянном давлении.
Удельная теплоемкость вещества с - величина, равная количеству теплоты, необходимому для нагревания 1 кг с = вещества на 1К. Единица удельной теплоемкости - Дж/(кг К)
c= 
Молярная теплоемкость C  - величина, равная количеству теплоты, необходимому для нагревания 1моль вещества на 1К. Единица молярной теплоемкости - Дж/(моль К).
- величина, равная количеству теплоты, необходимому для нагревания 1моль вещества на 1К. Единица молярной теплоемкости - Дж/(моль К).
C  =
= 
Связь между C  и с
и с
Различают теплоемкости (удельную и молярную) при постоянном объеме {сv и Сv) и при постоянном давлении (сp и СР), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
Молярная теплоемкость при постоянном объеме.
Из первого начала термодинамики  Q = dU +
Q = dU +  A, с учетом
A, с учетом  А=pdV и
А=pdV и
С  =
=  , для 1моль газа получим С
, для 1моль газа получим С  dT=dU
dT=dU  +pdU
+pdU 
При V = const работа внешних сил 5-4 равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии
Cv=dU  \dT
\dT
Cv равна изменению внутренней энергии 1моль газа при повышении его температуры на 1К.
Поскольку dU  =i\2RdT, то Cv=i\2R
=i\2RdT, то Cv=i\2R
Молярная теплоемкость при постоянном давлении. Уравнение Мазера.
Если газ нагревается при р = const, то
Cp= 
dU  \dT не зависит от вида процессов (внутренняя энергия идеального газа не зависит от p, ни от V, а определяется только T) и всегда равна Cv. Дифференцируя уравнение Клайперона-Менделеева pU
\dT не зависит от вида процессов (внутренняя энергия идеального газа не зависит от p, ни от V, а определяется только T) и всегда равна Cv. Дифференцируя уравнение Клайперона-Менделеева pU  =RT по T при p=const, получим
=RT по T при p=const, получим
Cp=Cv+R – уравнение Майера.
Cp всегда больше Cv на величину универсально газовой постоянной.
Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа
Cp=i\2R+R=i+2\2R
При рассмотрении термодинамических процессов важную роль играет величина

которая называется коэффициентом Пуассона
13. Термодинамический процесс. Работа газа и количество тепла гак характеристики
процессов. Первое начало термодинамики, его применение в изопроцессах.

Если находящийся под поршнем в цилиндрическом сосуде, газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу  , где S -площадь поршня.
, где S -площадь поршня.
Полная работа А, совершаемая газом при изменении его объема от V1 до V2
A= 
Равновесные процессы - это процессы, состоящие из последовательности равновесных состояний.
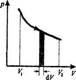
Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностно реальных процессов можно пренебречь.
Равновесные процессы можно изображать графически в координатах (p,V). Так работа 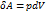 определяется площадью заштрихованной полоски, а полная работа - площадью под кривой между V1 и V2
определяется площадью заштрихованной полоски, а полная работа - площадью под кривой между V1 и V2
При неравновесных процессах значения параметров в разных частях системы различны и не существует (p,V) -точек, характеризующих состояние всей системы. Поэтому графическое изображение неравновесного процесса невозможно.