· 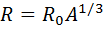 – радиус ядра.
– радиус ядра.
·  – энергия связи нуклонов в ядре.
– энергия связи нуклонов в ядре.
·  – дефект массы ядра.
– дефект массы ядра.
· 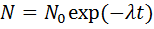 – закон радиоактивного распада.
– закон радиоактивного распада.
·  – период полураспада.
– период полураспада.
· 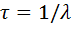 – среднее время жизни радиоактивного ядра.
– среднее время жизни радиоактивного ядра.
·  – активность нуклида.
– активность нуклида.
·  – правило смещения для α – распада.
– правило смещения для α – распада.
· • 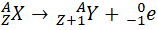 – правило смещения для
– правило смещения для  – распада.
– распада.
· •  – правило смещения для
– правило смещения для  – распада.
– распада.
· •  – символическая запись ядерной реакции.
– символическая запись ядерной реакции.
·
Библиографический список.
1. Трофимова Т. И. Курс физики. – М.: Высшая школа, 1997. – 542с.
2. Волькенштейн В. С. Сборник задач по общему курсу физики. – СП. – б.: Специальная литература, 1999. – 327 с.
3. Трофимова Т. И., Павлова З. Г. Сборник задач по курсу физики с решениями. – М.: Высшая школа, 2002. – 591 с.
4. Чертов А. Г., Воробьев А. А. Задачник по физике. – М.: Физматлит, 2003. – 639 с.
5. Савельев И. В. Курс общей физики (Электричество и магнетизм). – М.: АСТ, 2002. – 336 с.
6. Овчинников В. А., Демин В. Б., Познер А. А. Учебное пособие для поступающих в вузы. Екатеринбург: УМЦ – УПИ, 2003.
7. Першин В. К., Зольников П. П., Поленц И. В., Фишбейн Л. А., Хан Е. Б. Курс общей физики. Электродинамика. – Екатеринбург. «Издательство УМЦ – УПИ». – 2006. – 287 с.
8. Першин В. К., Зольников П. П., Фишбейн Л. А., Хан Е. Б., Чернобородова С. В. Курс общей физики. Механика. – Екатеринбург, «УрГУПС». – 2007. – 367 с.
9. Масленников Ю.И. Механика. Текстовые задания: сборник задач/ Ю.И.Масленников – Екатеринбург: УрГУПС, 2012 – 40с.
10. Масленников Ю.И. Электромагнетизм. Текстовые задания: Сборник задач / Ю.И. Масленников. Екатеринбург УрГУПС, 2012 – 40с
Приложение
Свойства идеального газа: 1) все вещества состоят из атомов и молекул, в ИГ размерами и взаимодействиями молекул пренебрегают; 2) все направления для движения молекул равновероятны; 3) между соударениями молекула движется прямолинейно; 4) длина свободного пробега (l) определяется размерами сосуда (l  1/n); 5) скорость молекул
1/n); 5) скорость молекул  и
и  ; 6) при одной температуре (T=) кинетические энергии молекул одинаковы
; 6) при одной температуре (T=) кинетические энергии молекул одинаковы  значит
значит  и наоборот.
и наоборот.
Основное уравнение МКТ. При упругом ударе о стенку импульс молекулы  . Импульс всех молекул
. Импульс всех молекул  , где S – площадь, n – концентрация, V – объем. В замкнутом объеме (кубе) давление на площадь S равно
, где S – площадь, n – концентрация, V – объем. В замкнутом объеме (кубе) давление на площадь S равно  (основное уравнение МКТ). При умножении левой и правой частей сначала на объем одного моля
(основное уравнение МКТ). При умножении левой и правой частей сначала на объем одного моля  , а затем на число молей
, а затем на число молей  , получим уравнения Менделеева Клапейрона (МК) для одного моля
, получим уравнения Менделеева Клапейрона (МК) для одного моля  и нескольких молей V.
и нескольких молей V.
Из уравнений МКТ и МК следуют газовые законы. Далее используя приведенные определения числа (количества вещества) молей  , молекулярной массы M, числа молекул в одном моле
, молекулярной массы M, числа молекул в одном моле  скорости молекул
скорости молекул  , получим формулы для нахождения давления
, получим формулы для нахождения давления  концентрации n и плотности
концентрации n и плотности  ; числа молекул N, числа молей
; числа молекул N, числа молей  , молярного объема
, молярного объема  , коэффициента диффузии молекул Д, внутренней энергии
, коэффициента диффузии молекул Д, внутренней энергии  .
.
Энтропия. Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. A =  – прямой круговой цикл, идущий по часовой стрелке. Прямой цикл используется в тепловых двигателях, где работа совершается за счет теплоты, полученной извне.
– прямой круговой цикл, идущий по часовой стрелке. Прямой цикл используется в тепловых двигателях, где работа совершается за счет теплоты, полученной извне.  – обратный круговой цикл, идущий против часовой стрелки. Обратный цикл используется в холодильных машинах, где за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате обратимого кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса
– обратный круговой цикл, идущий против часовой стрелки. Обратный цикл используется в холодильных машинах, где за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате обратимого кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса  . Термический коэффициент полезного действия для кругового процесса
. Термический коэффициент полезного действия для кругового процесса  .
.
Изменение энтропии.  – приведенное количество теплоты.
– приведенное количество теплоты.
 – это функция состояния системы (энтропия). Она не зависит от пути, каким система пришла в это состояние, она характеризует меру неупорядоченности системы.
– это функция состояния системы (энтропия). Она не зависит от пути, каким система пришла в это состояние, она характеризует меру неупорядоченности системы.
 – энтропия, где k – постоянная Больцмана, w – термодинамическая вероятность.
– энтропия, где k – постоянная Больцмана, w – термодинамическая вероятность.
Принцип возрастания энтропии – все процессы в замкнутой системе ведут к увеличению энтропии. Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (второй закон термодинамики).
Изменение энтропии при изотермическом процессе (m =,M =, pV=). Используя определения – приведенное количество теплоты и первое начало термодинамики (dU = 0,  Q = νRTdV) – запишем
Q = νRTdV) – запишем

Изменение энтропии при изохорическом процессе (m=, V=, M=,p/T =). Первое начало термодинамики –  ; pdV = 0, dU = ν
; pdV = 0, dU = ν  dT. Для идеального газа
dT. Для идеального газа 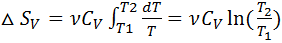 .
.
Изменение энтропии при изобарическом процессе (m =, M =,V/T =). Первое начало термодинамики –  . Приведенное количество теплоты характеризует изменение энтропии (δQ/T) –
. Приведенное количество теплоты характеризует изменение энтропии (δQ/T) –

