1. Вискозиметр промыть дистиллированной водой, затем – исследуемой жидкостью.
2. Через воронку в вискозиметр несколько выше расширения налить в колено 1 исследуемую жидкость.
3. Опустить зажим и при помощи резиновой груши медленно втянуть жидкость в колено 2 до тех пор, пока она заполнит узкий канал и шарообразные расширения. Зажать резиновую трубку зажимом, удалить резиновую грушу.
4. При помощи секундомера определить время истечения исследуемой жидкости (t). Для этого освободить резиновую трубку от зажима. Под действием собственного веса через узкий канал жидкость начинает вытекать. В момент, когда мениск жидкости проходит метку m (верхнюю отметку), включают секундомер, а когда через n (нижнюю отметку) – выключают. Записывают время истечения жидкости.
5. Повторить опыт 3 раза (пункт 3,4). Найти среднее значение времени (tср).
6. Промыть вискозиметр дистиллированной водой. Укрепить вискозиметр в штативе и наливают через воронку в колено1 эталонную жидкость (дистиллированную воду) до той метки как в случае исследуемой жидкости.
7. Определить время истечения эталонной жидкости через узкий канал (t0) между заданными отметками. Для этого повторяют опыт согласно пунктам 2-5.
8. Результаты измерений и вычислений занести в таблицу:
| № п/п | t, c | D t, c | t0,, с | D t0,, с |
| 1. | ||||
| 2. | ||||
| 3. | ||||
| ср. знач. |
9. Рассчитать по формуле (11) среднее значение коэффициента внутреннего трения жидкости η ср, подставив средние значения t0 ср, t ср.
§ плотность эталонной жидкости: ρ0=1000 кг/м3,
§ вязкость эталонной жидкости: η0=0,001 Па∙с,
§ плотность исследуемой жидкости: ρ=800 кг/м3.
10. Обработка результатов измерений производится как для косвенных измерений:
§ находят абсолютные погрешности прямых измерений:  ,
,  , и их средние значения Δ t ср,Δ t0 ср;
, и их средние значения Δ t ср,Δ t0 ср;
§ относительная погрешность определяется по формуле:

§ абсолютная погрешность косвенных измерений равна: Dh ср = Е h ср
11. Окончательный результат записать в виде:
h = (hср  Dhср.)
Dhср.)  при Е =
при Е =  ..%
..%
12. Отчет составить по указанию преподавателя.
Контрольные вопросы.
1. Что называется силой внутреннего трения (вязкости) жидкости?
2. Сформулируйте закон Ньютона.
3. Динамическая и кинематическая вязкость. Связь этих величин.
4. Какова зависимость коэффициента внутреннего трения от температуры?
5. Ламинарные и турбулентные потоки. Число Рейнольдса.
6. Распределение скорости при ламинарном движении.
7. Сформулируйте закон Пуазейля.
8. Вывод расчетной формулы.
Литература.
1. Трофимова Т.И. Курс физики.– М.: Высш.шк., 2001. – §§ 31,32.
2. Грабовский Р.И. Курс физики. – СПб.: Лань, 2002. – §52.
3. Бушок Г.Ф., Венгер Є.Ф. Курс фізики: у 3-х кн. Кн.1. Фізичні основи механіки. Молекулярна фізика і термодинаміка. – К.: Вища шк., 2002. – §§ 47, 48, 50.
ЛАБОРАТОРНАЯ РАБОТА № 2.3
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗА
МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ.
Цель: познакомится с основными характеристиками термодинамических
систем, понятием теплоемкости, научиться определять показатель
адиабаты методом адиабатического расширения.
Приборы и материалы: закрытый стеклянный баллон с краном, водяной манометр, ручной насос.
Теоретическое введение.
Основными характеристиками состояния термодинамической системы, являются внутренняя энергия (U), работа (А) и количество теплоты (Q).
Внутренняя энергия (U) – это суммарная энергия всех видов частиц, из которых состоит система. Сюда входят кинетическая и потенциальная энергия молекул, энергия колебательных движений атомов и молекул, энергия электронных оболочек в атомах и ионах и внутриядерная энергия. К внутренней энергии не относится энергия системы как целого, которой она характеризуется вследствие механического движения или взаимодействия с другими системами.
Внутренняя энергия системы является функцией состояния системы, то есть однозначно определяется теми же параметрами, что и система, не зависит от способа, с помощью которого система переводится из одного состояния в другое.
Для идеального газа внутренняя энергия определяется по формуле
U = 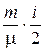 RT (1)
RT (1)
где T – температура;  – число молей в данной массе газа;
– число молей в данной массе газа;
R = 8,31 Дж/(моль·К) – универсальная газовая постоянная;
і – число степеней свободы молекулы газа.
Число степеней свободы (i) – число независимых координат, определяющих положение тела в пространстве.
Ниже в таблице 1 приведены значения i, в зависимости от числа атомом, входящих в молекулу.
таблица 1
| число атомов в молекуле | газ | число степеней свободы |
| одноатомные | He, Ar, Ne | i = 3 |
| двухатомные | O2, N2, CO | i = 5 |
| трех- и многоатомные | C2H4, C6H6, C2H5OH | i = 6 |
В термодинамике практическое значение имеет не сама энергия, а ее изменение, при переходе системы из одного состояния в другое.
Изменение внутренней энергии определенной массы газа:
 (2)
(2)
Изменить внутреннюю энергию системы можно двумя способами:
1) путем передачи системе определенного количества теплоты (δQ);
2) путем совершения работы (δ А).
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам, согласно которому, количество теплоты ( δQ), переданное системе, идет на изменение ее внутренней энергии (dU) и на совершение системой работы против внешних сил ( δ А):
δQ = dU + δ A (3)
где dU – бесконечно малое изменение внутренней энергии системы,
δ A – элементарная работа, δQ – бесконечно малое количество теплоты.
В выражении (3) dU – полный дифференциал (U – функция состояния системы, зависящая только от начального и конечного состояния системы); δQ, δ A – не являются полными дифференциалами системы, зависят от способа перехода системы из одного состояния в другое.
В выражении (3) все величины в СИ выражаются в джоулях (Дж).
Элементарная работа любого процесса равна:
 (4)
(4)
Измерение количества теплоты связано с понятием теплоемкости.
Теплоемкостью С называется физическая величина, равная количеству теплоты, необходимому для нагревания вещества на один кельвин (1К):
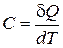
Единица измерения теплоемкости С в СИ: [ С ]=[Дж/К].
Количество теплоты, необходимое для нагревания одного килограмма (1кг) вещества на один кельвин (1К), называется у дельной теплоемкостью с:

Единица измерения удельной теплоемкости с в СИ: [ с ]=[Дж/(кг∙К)].
Количество теплоты, необходимое для нагревания одного моля вещества (1моль) на один кельвин (1К), называется молярной теплоемкостьюСµ:
 (5)
(5)
Единица измерения удельной теплоемкости Сµ в СИ: [Сµ]=[Дж/(моль∙К)].
Для газов удельная теплоемкость зависит от его природы и от способа нагревания. Различают теплоемкости:
§ при постоянном объеме (CV – молярная, сV – удельная),
§ при постоянном давлении (Сp – молярная, cp – удельная).
Запишем первое начало термодинамики, подставив (2), (4) в (3):
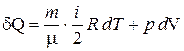 (6)
(6)
При постоянном объеме d V = 0, тогда для С V, с учетом (5), получим:
 (7)
(7)
Аналогично для Ср (для изобарного процесса  ):
):
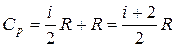 (8)
(8)
Сопоставляя (7) и (8), получим уравнение Майера:
 (9)
(9)
То есть теплоемкость Ср > CV на величину универсальной газовой постоянной R. Это объясняется тем, что при нагревании газа при постоянном давлении требуется дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема.
Из уравнения (9) можно определить физический смысл универсальной газовой постоянной R:
универсальная газовая постоянная численно равна работе по расширению
одного моля идеального газа при нагревании на 1 К при постоянном давлении.
Изменение состояния системы (процесс) связано с изменением ее параметров (p, T, V). В случае произвольного процесса для идеального газа уравнение состояния (уравнение Менделеева-Клапейрона) имеет вид:
 (10)
(10)
Для изопроцессов (один из параметров данной массы газа не меняется) связь параметров системы устанавливается газовыми законами: Бойля-Мариотта (изотермический), Гей-Люссака (изобарный), Шарля (изохорный). Эти законы являются частными случаями уравнения (10).
Изотермический процесс происходит без изменения температуры (T=const), вся сообщенная телу теплота идет на совершение работ.
Изохорный процесс происходит без изменения объема (V=const), переданная телу теплота идет на изменение внутренней энергии.
Изобарный процесс – процесс, при котором телу сообщается теплота без изменения давления (p = const).
Адиабатическим называется процесс, при котором отсутствует теплообмен тела с внешней средой (δQ = 0).
В таблице 2 приведено применение первого начала термодинамики к изопроцессам.
таблица 2
| Название изопроцесса | Закон | δA | dU | I начало термодинамики |
| Изотермический (T = const) | P V = const | δ A = pd V |  (dT =0) (dT =0)
| δQ = δ A |
| Изохорный (V = const) |  = const = const
| δ A= 0, (d V=0) | 
| δQ = dU |
| Изобарный (p = const) |  = const = const
| δ A = pd V | 
| δQ= dU + δ A |
| Адиабатический ( δQ = 0) | р Vg = const | δ A = pd V | 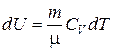
| δ A = – dU |
При адиабатическом процессе, в соответствии с первым законом термодинамики, работа выполняется за счет убывания внутренней энергии системы.
Уравнение этого процесса называется уравнением Пуассона:
р Vγ = const, (11)
где g =  – показатель адиабаты (коэффициент Пуассона).
– показатель адиабаты (коэффициент Пуассона).
Подставив в отношение g выражения для Cv и Ср (7), (8) можно вывести:
 , (12)
, (12)
где і – число степеней свободы молекул газа, значение которого зависит от числа атомов в молекулах.
В данной работе необходимо определить значение показателя адиабаты (коэффициента Пуассона) g=  для воздуха, используя метод адиабатного расширения – методом Клемана и Дезорма.
для воздуха, используя метод адиабатного расширения – методом Клемана и Дезорма.