Определение меди основано на реакции:
1) 2 CuSO4+4KI↔2CuI+I2+2K2SO4
2│Cu2++ẽ→Cu+
│ 2I—2 ẽ→I20
1 I2+2Na2S2O3→2NaI+Na2S4O8
I2+2ẽ→2I-
2S2O32—2ẽ→S4O82-
I2+2S2O32→2I-+ S4O82-
Из первого уравнения видно, что ион Сu2+ восстанавливается до Сu+ с образованием осадка иодистой меди. Эквивалент меди в этой реакции равен его атомной массе.
М(э) Сu=Аr=63,54г, М(э) CuSO4•5H2O=249,7г
При этом йод выделяется в свободном виде. Количество выделяющегося йода эквивалентно количеству окислителя (двухвалентной меди). Выделившийся йод оттитровывают тиосульфатом натрия. Точку эквивалентности определяют с помощью индикатора крахмала.
Равновесие в обратимой реакции (1) сдвинуто вправо вследствие образования осадка CuJ. Чтобы реакция практически протекала до конца, необходимо прибавить большой избыток KJ. Небольшая кислотность раствора ускоряет реакцию, подавляет гидролиз солей Cu2+.
Выполнение определения
1 Анализируемый раствор доводят в мерной колбе на 100 мл до метки дистиллированной водой.
2 В колбу для титрования наливают 10 мл 10% раствора KJ, 3 мл 2н раствора H2SO4, прибавляют аликвотную часть раствора соли меди (пипетку 10 мл). Смесь оставляют на 5 минут в темноте.
1. Выделившийся свободный йод титруют раствором тиосульфата натрия. Титрование проводят точно также, как и при установлении нормальной концентрации тиосульфата натрия.
Образовавшийся бледно-желтый осадок CuJ не мешает титрованию. Титрование проводят три раза, результат заносят в журнал:
V CuSO4, мл V Na2S2O3, мл индикатор
10,0 1 _________ крахмал
10,0 2__________
10,0 3__________
__________________
Vсреднее
Вычисление граммового содержания Cu2+ в растворах
1 Способ:
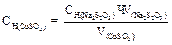 (моль/л)
(моль/л)
 (г/см3)
(г/см3)
 (г)
(г)
2 Способ:
 (г/см3)
(г/см3)
 (г).
(г).
Вопросы к разделу
1. Какой процесс лежит в основе методов окисления-восстановления?
2. Почему в ряде окислительно-восстановительных методов недопустима замена одного окислителя (восстановителя) другим окислителем (восстановителем)?
3. Какие реакции лежат в основе методов:
а) перманганатометрии;
б) иодометрии;
в) феррометрии;
4. Какая из количественных характеристик раствора меняется в процессе редоксиметрического титрования?
5. Как меняется в процессе редоксиметрического титрования потенциал пары, выступающей в роли:
а) окислителя;
б) восстановителя?
6. какие значения приобретают потенциалы взаимодействующих окислительно-восстановительных пар в точке эквивалентности?
7. Что представляют собой редоксиндикаторы? С чем связанно изменение их окраски?
8. Что такое область перехода окраски редоксиндикатора? Ее математическое выражение?
9. В чем заключаются достоинства и недостатки редоксиндикаторов?
10. Что представляют собой специальные индикаторы, используемые в редоксиметрическом титровании?
11. С какой целью прибегают к построению кривых титрования в редоксиметрии?
12. Почему до момента эквивалентности потенциала раствора вычисляют по концентрациям окислительно-восстановительной пары титруемого раствора, а после момента эквивалентности по концентрациям окислительно-восстановительной пары титранта?
13. Что такое «скачок» на кривой титрования? Какому процентному содержанию взаимодействующих компонентов соответствуют точки начала и конца скачка?
14. Каким образом величина скачка на кривой редоксиметрического титрования зависит от стандартных потенциалов реагирующих окислительно-восстановительных пар?
15. В чем заключается отличительная особенность кривой редоксиметрического титрования по сравнению с кривой кислотно-основного титрования?
16. Каким образом может быть увеличен скачок на кривой редоксиметрического титрования? С какой целью прибегают к его увеличению?
17. Как определяется грамм-эквивалент в редоксиметрии?
18. Какие из веществ в качестве стандартных могут быть использованы для установления нормальности раствора перманганата калия?
19. Какие условия необходимо создать для количественного определения железа (II) в растворе его соли при титровании раствором перманганата калия?
20. Чем объясняется возможность двоякого использования окислительно-восстановительной пары I2/2I- в титриметрическом анализе?
21. Какие условия необходимы для возможно более полного протекания реакции  : а) справа налево; б) слеванаправо?
: а) справа налево; б) слеванаправо?
22. Почему вдруг при титровании иода восстановителем индикатор (крахмал) вносят в титруемый раствор в конце титрования?
23. Почему иодометрические определения нельзя проводить в сильно щелочной среде?
24. Почему иодометрические определения нельзя проводить при нагревании?
25. В каких условиях проводится иодометрическое определение окислителей? Почему в данном случае необходимо использовать метод замещения?
26. Какие условия необходимы для иодометрического определения восстановителей?
27. Почему нельзя готовить по точной навеске титрованные растворы: а)перманганата калия; б) тиосульфата натрия?
28. Какие из веществ в качестве стандартных могут быть использованы для установления нормальности раствора тиосульфата натрия?
29. Почему невозможно прямое титрование раствора бихромата калия тиосульфатом натрия?
30. Почему установление нормальности раствора тиосульфата натрия по бихромату калия необходимо проводить в присутствии избытка иодистого калия?
31. Почему установление нормальности раствора тиосульфата натрия по бихромату калия недопустимым является как недостаточное количество кислоты, так и избыток ее?
32. Почему при иодометрическом определении окислителей исследуемый раствор перед титрованием необходимо выдержать в течении нескольких минут в закрытом пробкой сосуде, помещенном в темное место?
33. В чем заключается причина расхождения между предполагаемым и действительным направлением реакции иодометрического определения меди?
34. Почему при иодометрическом определении меди необходимо прибавлять к исследуемому раствору большое количество иодистого калия?
35. Почему иодометрическое определение меди необходимо проводить в слабокислой среде? Как мешают этому определению:
а) недостаточная кислотность раствора;
б) высокая кислотность раствора?
36. С какой целью перед ферролметрическим определением ванадия в исследуемый раствор добавляют смесь серной и фосфорной кислот?
37. Почему при феррометрическом определении хрома необходимо подкислять исследуемый раствор?