5.1 Анхимерное содействие.
Бис- β- хлорэтилсульфид ((ClCH2CH2)2S, горчичный газ, иприт) в водном растворе гидролизуется в несколько тысяч раз быстрее, чем первичные алкилхлориды. Щелочной гидролиз оптически активного 2-бромпропаноата [CH3CH(Br)COO¯] протекает с сохранением конфигурации. Гидролиз хлорамина [Et2NCH2CH(Cl)Et] дает перегруппированный спирт Et2NCH(Et)CH2OH.
Эти пути реакции являются примером участия соседних групп в нуклеофильном замещении, которое носит название анхимерного содействия:


Таким образом, в этих реакциях нуклеофильная функциональная группа (-SR, -COO¯, -NR2) реагирующей молекулы на какое-то время оказывается связанной (полностью или частично) с реакционным центром. Вероятность участия этой группы зависит от размеров цикла, образующегося в переходном состоянии. Предпочтительным является образование 3-, 5- и 6-членных циклов.
5.2 Нуклеофильное ароматическое замещение (SNAr).
Реакции нуклеофильного ароматического замещения можно описать общей схемой:

Реакции SNAr имеют свои особенности, поскольку механизм SN2, когда имеет место синхронное образование новой и разрыв старой связи в тригональном бипирамидальном переходном состоянии, не может осуществляться в ароматическом ряду, поскольку арилгалогениды, в отличие от алкилгалогенидов, не могут принять необходимую конформацию, т.к. тыльная сторона связи C-Y блокирована бензольным кольцом. Поэтому для реакции SNAr можно предположить механизм присоединения-отщепления с промежуточным образованием анионного σ -комплекса.

Такой механизм реализуется, когда в качестве заместителя Х в бензольном кольце присутствуют сильно электроноакцепторные группы (-NO2, -CN, SO2R, -N+≡N, способ-
 ные участвовать в делокализации отрицательного заряда σ -комплекса.
ные участвовать в делокализации отрицательного заряда σ -комплекса.
Не активированные электроноакцепторными заместителями арилгалогениды реагируют с сильными нуклеофилами (сильными основаниями) по механизму отщепления - присоединения. На первой стадии нуклеофил действует как основание, отщепляя протон в орто -положении к атому галогена. Образовавшийся карбанион быстро выбрасывает анион галогенида, образуя очень малостабильную частицу с тройной связью С≡С, называемую дегидроареном или арином (при Х=Н- дегидробензолом или бенз-ином)

Ввиду очень низкой СН-кислотности ароматических соединений для протекания этой реакции необходимы сильные основания, например, гидроксил- (OH¯) или амид (NH2¯) ионы и высокие температуры (300-400оС).
5.3 Анион-радикальное нуклеофильное ароматическое замещение (SRN1).
Реакции нуклеофильного замещения галогена в неактивированных ароматических соединениях могут протекать по механизму одноэлектронного переноса при участии нуклеофилов - восстановителей. В качестве восстановителя может быть использован сольватированный электрон, получаемый при растворении металлического калия или
натрия в жидком аммиаке, а также другие нуклеофилы, обычно при инициировании УФ-облучением. В результате переноса одного электрона на молекулу арилгалогенида образуется анион-радикал ArX  , который быстро отщепляет галогенид-ион, образуя арил-радикал Ar•. Он присоединяет нуклеофильный реагент Nu:¯, который является “ловушкой” радикала Ar•. Завершает этот цепной ион-радикальный процесс перенос электрона от анион-радикала ArNu
, который быстро отщепляет галогенид-ион, образуя арил-радикал Ar•. Он присоединяет нуклеофильный реагент Nu:¯, который является “ловушкой” радикала Ar•. Завершает этот цепной ион-радикальный процесс перенос электрона от анион-радикала ArNu  к исходному субстрату ArX. Схема
к исходному субстрату ArX. Схема  реакции выглядит следующим образом:
реакции выглядит следующим образом:
В ряду арилгалогенидов наиболее склонны к восстановлению арилиодиды, поэтому триметилиодбензолы реагируют с амидом калия по механизму SRN1, а хлор – и бром- производные – по ариновому механизму.
5.4 Викариозное нуклеофильное замещение (SNHAr).
Обычно в реакциях нуклеофильного ароматического замещения в качестве уходящей группы (нуклеофуга) фигурируют электроотрицательные атомы или группы (в виде анионов или нейтральных молекул). Атом водорода не замещается в анионных σ -комплексах, так как гидрид-ион - слишком слабый нуклеофуг. Чтобы получить продукт замещения водорода, нуклеофуг должен содержать группу Х, способную отщепляться в виде НХ от промежуточного σ -комплекса, например,

Таким образом, 1,3,5-тринитробензол или 2,4,6-тринитроанилин можно легко превратить в 1,3,5-триамино-2,4,6-тринитробензол (ТАТБ) – малочувствительное термостойкое ВВ.

Ввиду того, что вместо нормального ‘отщепления” гидрид-иона Н¯ происходит отщепление протона, а уходящей группой является N(CH3)3, расположенная не в геминальном узле анионного σ -комплекса, а в боковой цепи, эта реакция получила название викариозного нуклеофильного замещения (от англ. vicarious- действующий вместо другого, по уполномочию).
5.5 Мономолекулярное нуклеофильное ароматическое замещение (SN1).
В отличие от алкил - и аралкилгалогенидов, арилгалогениды не склонны реагировать по механизму SN1 с промежуточным образованием фенильного катиона С6H5+, т.к. 6π - электронная система бензола не принимает участия в делокализации положительного заряда (пустая sp2 -гибридная орбиталь катиона лежит в плоскости кольца и ортогональна ароматическому секстету π-электронов).
Так, энтальпия образования изопропильного (190 ккал/моль) и трет.-бутильного (174 ккал/моль) катионов в газовой фазе значительно ниже энтальпии образования фенильного катиона (223 ккал/моль). Пространственные условия сольватации фенильного катиона также значительно хуже, чем плоских алкильных катионов.
Единственно известным примером реакции мономолекулярного нуклеофильного ароматического замещения является разложение ароматических солей диазония в отсутствие восстановителей и сильных оснований:

В качестве нуклеофила NuH может выступать вода, в этом случае продуктами реакции являются фенолы.
6. Электрофильное ароматическое замещение (SEAr).
Как отмечалось выше (стр.18), бимолекулярное электрофильное замещение характерно для ароматических соединений и является одной из наиболее подробно изученных реакций, на кинетике и механизме которой базируются многие положения современной теоретической органической химии. Реакция представляет собой двухстадийный последовательный процесс с обратимой первой стадией, в результате ко
торой образуется реакционноспособное промежуточное соединение – аренониевый ион или σ -комплекс:

В структуре промежуточного σ -комплекса ароматическая 6 π-электронная система заменяется на 4 π-электронную систему пентадиенильного катиона (C=C-C=C-C+←→
+C-C=C-C=C), а на второй стадии в результате отщепления протона ароматическая система восстанавливается. В структуре σ -комплекса один из ароматических атомов переходит из состояния гибридизации sp2 (плоской тригональной) в sp3 (тетраэдрическую):

Положительный заряд аренониевого иона, как показано на вышеприведенной схеме реакции, в основном находится в орто - и пара -положениях бензольного ядра по отношению к геминальному центру, поэтому σ -комплекс стабилизируется электронодонорными заместителями, находящимися в этих положениях. Таким образом, донорные (+М) заместители ориентируют электрофил в орто - и пара -положения, т.е. реакция является региоселективной.
В переходном состоянии, предшествующем образованию σ -комплекса, состоящем из молекулы монозамещенного бензола C6H5X и положительно заряженного электрофила E+, заряд поделен между атакующим реагентом и бензольным кольцом. Если переходное состояние “раннее” (т.е. похожее на реагенты), то заряд в бензольном кольце невелик и в основном локализован на электрофиле, а если переходное состояние “позднее” (т.е. похожее на аренониевый ион), то заряд в основном локализован на атомах углерода бензольного кольца. Для реакций монозамещенных бензолов могут существовать четыре σ -комплекса: орто-, мета-, пара- и ипсо - (что означает замещение в положение, несущее заместитель, отличный от водорода):

В соответствии с этим могут быть четыре разных переходных состояния, энергия которых зависит от степени взаимодействия заместителя Х с положительным зарядом кольца. В “позднем” переходном состоянии полярный эффект заместителя Х должен быть выражен сильнее, чем в “раннем” переходном состоянии, но качественно влияние одного и того же заместителя должно быть одинаковым.
Из орто-, мета-, пара- σ -комплексов образуются продукты замещения водорода (путем отщепления протона), но из ипсо -комплекса может образоваться продукт замещения группы Х путем отщепления катиона Х+. Ипсо -замещение характерно для металлоорганических соединений, в которых металл замещается легче протона:
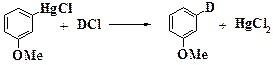
Реже встречается ипсо -замещение при X=Alk, Br или I. Для других замещенных бензолов (X=OH, NR2, NO2, CN, COR, F) ипсо -замещение не происходит, т.к. эти заместители должны отрываться в виде весьма неустойчивых катионов X+. Заместители Х по легкости их отрыва в виде катионов располагаются в ряд NO2< i-Pr < SO3- < t-Bu ≈ Ar-N=NO < H < HgCl.
Последовательность расположения групп Х в этом ряду соответствует устойчивости соответствующего катиона в растворе.