Упражнение 1. Изучение спектра излучения лампы накаливания.
Пронаблюдайте с помощью монохроматора спектр излучения лампы накаливания, используя в качестве источника света осветитель ОИ-19. Определите границы ( и
и  ) спектральных интервалов, которые соответствуют лучам разной цветности в наблюдаемом спектре излучения. (Естественно, что четких границ не существует, их положение является в определенной степени условным, зависящим от зрительного восприятия цветовых оттенков наблюдателем).
) спектральных интервалов, которые соответствуют лучам разной цветности в наблюдаемом спектре излучения. (Естественно, что четких границ не существует, их положение является в определенной степени условным, зависящим от зрительного восприятия цветовых оттенков наблюдателем).
Результаты измерений сведите в табл. 1.
Таблица 1
| Цветность лучей |  ,
угл. град. ,
угл. град.
|  ,
угл. град ,
угл. град
| Интервал длин волн  ÷ ÷  , нм , нм
|
| Красные | |||
| Оранжевые | |||
| Желтые | |||
| Зеленые | |||
| Голубые | |||
| Синие | |||
| Фиолетовые |
Используя цветные фломастеры, изобразите исследуемый спектр вдоль равномерной горизонтально расположенной оси значений λ (см. рис. 2).
Упражнение 2. Изучение спектра излучения атомарного газа.
Установите перед входной щелью монохроматора газоразрядную трубку с атомарным газом (гелием или криптоном). Попросите преподавателя или лаборанта включить источник высокого напряжения, обеспечивающий протекание электрического разряда внутри трубки, сопровождаемого свечением газа.
Пронаблюдайте спектр излучения атомов исследуемого газа. Определите длины волн наблюдаемых спектральных линий. Результаты измерений запишите в табл. 2.
Таблица 2
| Цвет линии |  угл. град.
угл. град.
| λ, нм |
Используя цветные фломастеры, изобразите исследуемый спектр излучения на рисунке. Как соотносится спектр излучения атомов исследуемого газа со спектрами, представленными на рис. 2 для атомов других веществ?
Упражнение 3. Изучение спектров поглощения.
Осветите входную щель монохроматора лампой накаливания. Убедитесь, что в поле зрения окуляра монохроматора наблюдается достаточно яркий сплошной спектр. Установите в световой пучок исследуемый образец (светофильтр, кювету с раствором фуксина, марганцевокислого калия или другой жидкостью в соответствии с заданием преподавателя).
Определите спектральные интервалы, которые соответствуют наиболее эффективному поглощению света исследуемым веществом.
Отразите рисунком характер спектра поглощения для каждого исследованного вещества. Для этого на фоне сплошного спектра выделите черным цветом области эффективного поглощения.
Контрольные вопросы
1. Какое явление лежит в основе устройства и принципа действия призматических спектральных аппаратов? В чем это явление состоит? Приведите примеры проявлений этого явления в природе, в оптических опытах.
2. Что понимается под спектром излучения (поглощения) тела? Какие типы спектров излучения (поглощения) Вам известны? Для каких тел они характерны?
3. Опишите оптическую схему монохроматора УМ-2. Как с помощью этого прибора измеряется длина волны в спектрах излучения и поглощения тел?
4. Какие факты лежат в основе метода спектрального анализа химического состава веществ?
5. Как по спектру излучения некоторого сложного вещества, находящегося в газообразном или парообразном состоянии, можно судить о наличии в этом веществе атомов некоторого химического элемента и его процентном содержании?
Лабораторная работа № 14
Изучение спектра водорода
Цели работы: градуировка монохроматора по спектру излучения ртути; исследование видимой части спектра атомарного водорода и анализ соответствия результатов эксперимента теории Бора; определение постоянной Ридберга.
Приборы и принадлежности: монохроматор УМ-2, ртутная лампа с блоком питания, водородная спектральная трубка, катушка Румкорфа, выпрямитель, собирающая линза.
Литература: [1], § 208 – 209, 211 – 212; [2], § 63 – 64; [4], § 43 – 44, 49 - 50; [5], § 210, 212.
В в е д е н и е
В 1911 г. английский физик Э.Резерфорд на основе проведенных опытов по зондированию структуры атомов с помощью быстрых α -частиц предложил планетарную модель строения атома: в центре атома находится положительно заряженное ядро, имеющее размеры порядка 10-15 м; в ядре сосредоточена практически вся масса атома; вокруг ядра по круговым или эллиптическим орбитам под действием кулоновских сил обращаются электроны.
Однако, эта модель с учетом классической электродинамики противоречила экспериментальным фактам. Так, двигаясь ускоренно по круговой или эллиптической орбите, электрон должен излучать электромагнитные волны. В результате этого он будет терять свою энергию и быстро приближаться к ядру. С точки зрения законов классической электродинамики электрон, двигаясь первоначально по орбите диаметром 10-10 м, за время τ » 10-11 с должен упасть на ядро. Опыт, однако, свидетельствует, что время жизни атома в отсутствии внешнего воздействия является бесконечным.
Вторая проблема планетарной модели была связана со структурой спектра излучения атома. По классической электродинамике частота электромагнитной волны, излучаемой электроном, должна соответствовать частоте его обращения вокруг ядра. При приближении электрона к ядру частота обращения будет постепенно увеличиваться. Следовательно, спектр излучения отдельного атома должен быть сплошным (или непрерывным). Однако, проведенные в конце 19 века исследования показали, что спектры излучения одиночных атомов являются дискретными. Они представляют собой совокупность узких линий, расположение и относительная интенсивность которых однозначно соответствует данному химическому элементу.
Смелую попытку спасти планетарную модель атома и объяснить дискретную структуру атомных спектров предпринял в 1913 г. молодой датский физик Н.Бор, который выдвинул следующие постулаты для атома водорода (или водородоподобного атома).
1. В атоме существует набор стационарных состояний, находясь в которых атом не излучает и не поглощает электромагнитных волн.
2. В стационарных состояниях атома момент импульса электрона, движущегося по круговой орбите, кратен постоянной Планка ћ:
 (n=1,2,3...). (1)
(n=1,2,3...). (1)
Здесь m - масса электрона, v - его скорость, n - квантовое число, определяющее номер состояния, rn – радиус n-ой стационарной орбиты.
3. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант энергии

Здесь En и Em – энергия атома в стационарных состояниях с номерами n и m соответственно.
В том же, 1913 г., существование стационарных состояний у атомов было подтверждено экспериментально опытами Франка и Герца.
Согласно модели Бора стационарные орбиты электрона в атоме водорода, кроме квантового условия устойчивости (1), должны удовлетворять второму закону Ньютона: ma = F. Учитывая, что центростремительное ускорение  а F – сила кулоновского взаимодействия электрона с ядром, заряды которых одинаковы по модулю и равны е, получим:
а F – сила кулоновского взаимодействия электрона с ядром, заряды которых одинаковы по модулю и равны е, получим:
 (2)
(2)
Здесь ε0 – электрическая постоянная.
Исключив из уравнений (1) и (2) скорость v, найдем формулу для радиуса стационарной орбиты:
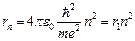 . (3)
. (3)
Радиус «первой боровской орбиты» r 1выражается через фундаментальные физические постоянные. Расчет дает, что
r 1»0‚53∙10-10м = 5,3∙10-2нм.
С ростом номера орбиты ее радиус увеличивается, как n2.
Энергия атома Еn в стационарном состоянии равна, по модели Бора, сумме кинетической энергии электрона на стационарной орбите и потенциальной энергии взаимодействия электрона с ядром:

Исключая v с помощью уравнения (2), получим:

С учетом (3) выражение для энергии стационарного состояния атома принимает вид:
 . (4)
. (4)
Подставив численные значения констант, получим
 . (5)
. (5)
Состояние с наименьшей энергией Е 1= -13,6 эВ называется основным. Заметим, что состоянию с  соответствует ситуация, когда электрон находится на бесконечно большом расстоянии от ядра и покоится. Положительная по знаку энергия соответствует электрону, движущемуся вне атома.
соответствует ситуация, когда электрон находится на бесконечно большом расстоянии от ядра и покоится. Положительная по знаку энергия соответствует электрону, движущемуся вне атома.
При переходе электрона с n -ой стационарной орбиты на орбиту с номером m (n > m) излучается квант энергии
 .
.
Принимая во внимание, что

(с – скорость света), получим что длина волны электромагнитного излучения, возникающего при переходе атома между состояниями n и m, удовлетворяет соотношению:
 . (6)
. (6)
Здесь R – так называемая постоянная Ридберга. Расчет дает, что R »1,1∙107 м-1.
Таким образом, длина волны излучения одиночных атомов не может быть любой, а принимает ряд определенных значений. Это соответствует линейчатому спектру излучения.
Расчет по формуле (6) дает, что при переходах атома с вышележащих уровней энергии на первый длина волны 91 £ λ £ 121 нм. Эта серия спектральных линий соответствует ультрафиолетовому излучению (открыта экспериментально Лайманом в 1906 г.).
Если электрон в атоме переходит с вышележащей орбиты на вторую, то 364 £ λ £ 656 нм. При этом часть спектральных линий попадает в видимую область. Эта серия линий была открыта Бальмером в 1875 г.
Переходам на 3-й, 4-й и 5-й уровни соответствуют серии спектральных линий (Пашена, Брэкета и Пфунда), лежащие в инфракрасной области.
На рис.1 представлена диаграмма энергетических состояний атома водорода и показаны некоторые переходы, соответствующие отдельным спектральным сериям.
 |
Рис. 1
Заметим, что с ростом квантового числа n энергетический спектр состояний атома водорода теряет свой квантовый характер: расстояние между соседними энергетическими уровнями уменьшается, стремясь к нулю. Состояния с энергией Е > 0 не квантуются.
Если электрон находится в основном состоянии (n = 1), то для ионизации атома, т.е. для осуществления перехода в состояние с Е ³ 0, необходимо, чтобы атом поглотил квант энергии hν ³ 13,6 эВ.
Теория Бора, как оказалось, очень хорошо описывает количественные закономерности в спектре излучения атома водорода. Тем самым, она явилась отправной точкой в становлении квантовой теории атома. Вскоре, однако, выявились ее трудности. Теория Бора
· не смогла объяснить спектры излучения других, более сложных атомов, чем атом водорода;
· не дает рецепта по вычислению важнейших характеристик спектральных линий – их интенсивности;
· не может объяснить природу химических связей атомов в молекулах
и т.д.
Весьма рельефна внутренняя противоречивость этой теории: наряду с чуждым классической физике условием квантования электронных орбит (2), в теории используется второй закон Ньютона, лежащий в основе классической механики.
Открытие в 20-х годах 19 века волновых свойств у микрочастиц позволило построить современную квантовомеханическую теорию атома, в которой в значительной степени были преодолены трудности теории Бора.