Все остальные элементы являются металлами.
Таблица 3. Квантовые числа
| Квантовые числа | Главное n | Орбитальное l | Магнитное m | Спин s |
| Возможные значения квантовых чисел | Любое натуральное число от 1 по 7 | Любое целое число от 0 по n -1 (l ≤ 3) | Любое целое число от - l по l | -1/2 и 1/2 |
| Обозначения значений | 1 - K; 2 – L; 3 – M; 4 – N; 5 – O; 6 – P; 7 - Q | 0 – s; 1- p; 2 – d; 3 - f | -1/2 - ↓; 1/2 - ↑ | |
| Свойства АО и электрона, которые определяются значениями данного квантового числа | Размер АО; энергия АО и электрона | Форма АО; энергия АО и электрона | Пространственная ориентация АО (l > 0); форма АО (l = 2 и 3) | Магнитные свойства электрона |
Таблица 4. Геометрические формы АО при различных значениях орбитального квантового числа
| Значение l | Обозначение АО | Геометрические формы АО |
| ns- орбиталь | 
| |
| nр- орбиталь | 
| |
| пd- орбиталь | 
| |
| nf- орбиталь | 
|
Таблица 5. Количества подуровней, АО и электронов на уровнях, подуровнях и АО
| Число | На уровне | На подуровне | На АО |
 подуровней подуровней
| n, при n = 1, 2, 3, 4; 4, при n = 5, 6, 7 | - | |
| АО |  n 2 , при n = 1, 2, 3, 4;
16, при n = 5, 6, 7 n 2 , при n = 1, 2, 3, 4;
16, при n = 5, 6, 7
| 2 l + 1 на ns - 1; на пр - 3; на пd -5; на nf - 7 | |
| электронов (максимальноечисло) |  2 n 2 , при n = 1, 2, 3, 4;
32, при n = 5, 6, 7 2 n 2 , при n = 1, 2, 3, 4;
32, при n = 5, 6, 7
| 4 1 + 2 на ns - 2; на пр - 6; на пd - 10; на nf - 14 |

Таблица 6. Электронные формулы атомов элементов в основном состоянии (в скобках указана принадлежность к электронному семейству s‑, p‑, d‑ или f‑ элементов; подчеркнуты обозначения валентных электронов)
| элемент | краткая электронная формула | элемент | краткая электронная формула |
| Ac | [Rn] 6 d 17 s 2 (f) | Hs | [Rn]5 f 14 6 d 67 s 2 (d) |
| Ag | [Kr] 4 d 105 s 1 (d) | I | [Kr]4 d 10 5 s 25 p 5 (p) |
| Al | [Ne] 3 s 23 p 1 (p) | In | [Kr]4 d 10 5 s 25 p 1 (p) |
| Am | [Rn] 5 f 77 s 2 (f) | Ir | [Xe]4 f 14 5 d 76 s 2 (d) |
| Ar | [Ne] 3 s 23 p 6 (p) | K | [Ar] 4 s 1 (s) |
| As | [Ar]3 d 10 4 s 24 p 3 (p) | Kr | [Ar]3 d 10 4 s 24 p 6 (p) |
| At | [Xe]4 f 145 d 10 6 s 26 p 5 (p) | La | [Xe] 5 d 16 s 2 (f) |
| Au | [Xe]4 f 14 5 d 106 s 1 (p) | Li | [He] 2s1 (s) |
| B | [He] 2 s 22 p 1 (p) | Lr | [Rn]5 f 14 6 d 17 s 2 (d) |
| Ba | [Xe] 6 s 2 (s) | Lu | [Xe]4 f 14 5 d 16 s 2 (d) |
| Be | [He] 2s2 (s) | Md | [Rn] 5 f 137 s 2 (f) |
| Bh | [Rn]5 f 14 6 d 57 s 2 (d) | Mg | [Ne] 3 s 2 (s) |
| Bi | [Xe]4 f 145 d 10 6 s 26 p 3 (p) | Mn | [Ar] 3 d 54 s 2 (d) |
| Bk | [Rn] 5 f 86 d 17 s 2 (f) | Mo | [Kr] 4 d 55 s 1 (d) |
| Br | [Ar]3 d 10 4 s 24 p 5 (p) | Mt | [Rn]5 f 14 6 d 77 s 2 (d) |
| C | [He] 2 s 22 p 2 (p) | N | [He] 2 s 22 p 3 (p) |
| Ca | [Ar] 4 s 2 (s) | Na | [Ne] 3 s 1 (s) |
| Cd | [Kr]4 d 10 5 s 2 (d) | Nb | [Kr] 4 d 45 s 1 (d) |
| Ce | [Xe] 4 f 15 d 16 s 2 (f) | Nd | [Xe] 4 f 46 s 2 (f) |
| Cf | [Rn] 5 f 107 s 2 (f) | Ne | [He] 2 s 22 p 6 (p) |
| Cl | [Ne] 3 s 23 p 5 (p) | Ni | [Ar] 3 d 84 s 2 (d) |
| Cm | [Rn] 5 f 76 d 17 s 2 (f) | No | [Rn] 5 f 147 s 2 (f) |
| Co | [Ar] 3 d 74 s 2 (d) | Np | [Rn] 5 f 46 d 17 s 2 (f) |
| Cr | [Ar] 3 d 54 s 1 (d) | O | [He] 2 s 22 p 4 (p) |
| Cs | [Xe] 6 s 1 (s) | Os | [Xe]4 f 14 5 d 66 s 2 (d) |
| Cu | [Ar] 3 d 104 s 1 (d) | P | [Ne] 3 s 23 p 3 (p) |
| Db | [Rn]5 f 14 6 d 37 s 2 (d) | Pa | [Rn] 5 f 26 d 17 s 2 (f) |
| Ds | [Rn]5 f 14 6 d 87 s 2 (d) | Pb | [Xe]4 f 145 d 10 6 s 26 p 2 (p) |
| Dy | [Xe] 4 f 106 s 2 (f) | Pd | [Kr] 4 d 10 (d) |
| Er | [Xe] 4 f 126 s 2 (f) | Pm | [Xe] 4 f 56 s 2 (f) |
| Es | [Rn] 5 f 117 s 2 (f) | Po | [Xe]4 f 145 d 10 6 s 26 p 4 (p) |
| Eu | [Xe] 4 f 76 s 2 (f) | Pr | [Xe] 4 f 36 s 2 (f) |
| F | [He] 2 s 22 p 5 (p) | Pt | [Xe]4 f 14 5 d 96 s 1 (d) |
| Fe | [Ar] 3 d 64 s 2 (d) | Pu | [Rn] 5 f 67 s 2 (f) |
| Fm | [Rn] 5 f 127 s 2 (f) | Ra | [Rn] 7 s 2 (s) |
| Fr | [Rn] 7 s 1 (s) | Rb | [Kr] 5 s 1 (s) |
| Ga | [Ar]3 d 10 4 s 24 p 1 (p) | Re | [Xe]4 f 14 5 d 56 s 2 (d) |
| Gd | [Xe] 4 f 75 d 16 s 2 (f) | Rf | [Rn]5 f 14 6 d 27 s 2 (d) |
| Ge | [Ar]3 d 10 4 s 24 p 2 (p) | Rh | [Kr] 4 d 85 s 1 (d) |
| H | 1 s 1 (s) | Rn | [Xe]4 f 145 d 10 6 s 26 p 6 (p) |
| He | 1 s 2 (s) | Ru | [Kr] 4 d 75 s 1 (d) |
| Hf | [Xe]4 f 14 5 d 26 s 2 (d) | S | [Ne] 3 s 23 p 4 (p) |
| Hg | [Xe]4 f 145 d 10 6 s 2 (d) | Sb | [Kr]4 d 10 5 s 25 p 3 (p) |
| Ho | [Xe] 4 f 116 s 2 (f) | Sc | [Ar] 3 d 14 s 2 (d) |
| элемент | краткая электронная формула | элемент | краткая электронная формула |
| Se | [Ar]3 d 10 4 s 24 p 4 (p) | Ti | [Ar] 3 d 24 s 2 (d) |
| Sg | [Rn]5 f 14 6 d 47 s 2 (d) | Tl | [Xe]4 f 145 d 10 6 s 26 p 1 (p) |
| Si | [Ne] 3 s 23 p 2 (p) | Tm | [Xe] 4 f 136 s 2 (f) |
| Sm | [Xe] 4 f 66 s 2 (f) | U | [Rn] 5 f 36 d 17 s 2 (f) |
| Sn | [Kr]4 d 10 5 s 25 p 2 (p) | V | [Ar] 3 d 34 s 2 (d) |
| Sr | [Kr] 5 s 2 (s) | W | [Xe]4 f 14 5 d 46 s 2 (d) |
| Ta | [Xe]4 f 14 5 d 36 s 2 (d) | Xe | [Kr]4 d 10 5 s 25 p 6 (p) |
| Tb | [Xe] 4 f 96 s 2 (f) | Y | [Kr] 4 d 15 s 2 (d) |
| Tc | [Kr] 4 d 55 s 2 (d) | Yb | [Xe] 4 f 146 s 2 (f) |
| Te | [Kr]4 d 10 5 s 25 p 4 (p) | Zn | [Ar]3 d 10 4 s 2 (d) |
| Th | [Rn] 6 d 27 s 2 (f) | Zr | [Kr] 4 d 25 s 2 (d) |
Таблица 7. Формы высших оксидов и гидроксидов элементов
| номер группы | I | II | III | IV | V | VI | VII |
| формулы высших оксидов | Э2O | ЭO | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 |
| формулы высших гидроксидов | ЭOH | Э(OH)2 | Э(OH)3 | H2ЭO3 (Э=C,Si), или Э(OH)4 (Э≠C,Si) | HЭO3 | H2ЭO4 | HЭO4 |
Таблица 8. Формы газообразных водородных соединений элементов
| Номер группы | IVA | VA | VIA | VIIA |
| Формулы водородных соединений | ЭН4 | ЭH3 | Н2Э | НЭ |
Таблица 9. Характер изменения некоторых свойств элементов в периодах и в подгруппах с ростом порядкового номера
| Свойства элементов | Характер изменения свойств с ростом порядкового номера | |
| в периоде | в подгруппе | |
| Атомные и ионные радиусы | ¯ | |
| Энергии ионизации | | ¯ |
| Электроотрицательности | | ¯ |
| Неметаллические свойства | | ¯ |
| Металлические свойства | ¯ | |
| Окислительные свойства | | ¯ |
| Восстановительные свойства | ¯ | |
| Кислотно-оснóвные свойства оксидов и гидроксидов | кислотные - | кислотные -¯ |
| оснóвные - ¯ | оснóвные - |
Примечания: - возрастают, усиливаются; ¯ - убывают, ослабевают.
Таблица 10. Электроотрицательности (ЭО) некоторых элементов:
| Элемент | As | B | Ba | Be | Br | C | Ca | Cl | Cs | F | Ge | H | I |
| ЭО | 2,0 | 2,0 | 0,9 | 1,5 | 2,8 | 2,5 | 1,0 | 3,0 | 0,7 | 4,0 | 1,8 | 2,1 | 2,5 |
| Элемент | K | Li | N | Na | O | P | Rb | S | Se | Si | Sr | Te | Zn |
| ЭО | 0,8 | 1,0 | 3,0 | 0,9 | 3,5 | 2,1 | 0,8 | 2,5 | 2,4 | 1,8 | 0,9 | 2,1 | 1,7 |
Таблица 11. Простейшие виды σ- и π-связей
| Перекрывающиеся АО связанных атомов | вид связи | характер перекрывания АО |
| s- АОи s- АО | σ-связь | 
|
| s- АОи p- АО | σ-связь | 
|
| p- АО и p- АО | σ-связь | 
|
| π-связь | 
| или так:

|
| sp n - АОи s- АО (n =1-3) | σ-связь | 
|
| sp n - АОи p- АО (n =1-3) | σ-связь | 
|
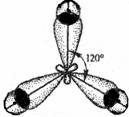
Таблица 12. Простейшие типы гибридизации АО
| тип гибридизации валентных АО | взаимное расположение валентных АО |
| sp- гибридизация | 
|
| sp 2 - гибридизация | 
|
| sp 3 - гибридизация | 
|
Таблица 13. Строение простейших молекул
| Моле- кула | Элемент A | Элемент B | Формула Льюиса | Крат-ность | Схема перекрывания атомных орбиталей | Геометрическая форма |
| A2 | H, IA-группа | - | 
| 
| линейная | |
| A2 | VIIA-группа | - | 
| 
| линейная | |
| A2 | VIA-группа | - | 
| 
| линейная | |
| A2 | VA-группа | - | 
| 
| линейная | |
| AB | H | VIIA-группа |

|

| линейная | |
| A2B | H | VIA-группа |

|

| угловая | |
| AB2 | VIA-группа | VIIA-группа | 
|

| угловая | |
| AB2 | IIA-группа | H |

|

| линейная | |
| AB2 | IIA-группа | VIIA-группа |

|

| линейная | |
| AB3 | VA-группа | H | 
|

| треугольно-пирамидальная | |
| AB3 | VA-группа | VIIA-группа |

|

| треугольно-пирамидальная | |
| A3B | VIIA-группа | VA-группа |

| |||
| AB3 | IIIA-группа | H | 
|
| плоско-треугольная | |
| AB3 | IIIA-группа | VIIA-группа |

|

| плоско-треугольная | |
| AB4 | IVA-группа | H | 
|

| тетраэдрическая | |
| AB4 | IVA-группа | VIIA-группа | 
| 
| тетраэдрическая |
Перечень (2) неорганических сильных кислот
HBr, HBrO3, HBrO4, HCl, HClO3, HClO4, H2Cr2O7, HI, HIO3, HMnO4, HNCS, HNO3, HReO4, H2SO4, H2SeO4, HTcO4.
Все прочие кислоты – слабые!
Перечень (3) неорганических сильных оснований (щелочей)
МОН (M = Cs, Fr, К, Li, Na, Rb, Tl); M(OH)2 (M = Ba, Ca, Ra, Sr).
Таблица 14. Растворимость электролитов в воде при комнатной температуре (все соединения Cs+, H+, K+, NH  , Na+, Rb+ и нижеприведенных анионов растворимы; все соединения CH3COO
, Na+, Rb+ и нижеприведенных анионов растворимы; все соединения CH3COO  , ClO
, ClO  , HCOO
, HCOO  , NO
, NO  и нижеприведенных катионов растворимы)
и нижеприведенных катионов растворимы)
| катионы | анионы | |||||||||||
Br 
| CO 
| C2O 
| Cl 
| CrO 
| F 
| I 
| OH 
| РO 
| S 
| SO 
| SO 
| |
| Ag+ | Н | Н | Н | Н | Н | Р | Н | — | Н | Н | Н | М |
| Al3+ | Р | — | Н | Р | Р | Н | Н | Н | Н | — | — | Р |
| Ba2+ | Р | Н | Н | Р | Н | М | Р | Р | Н | Р | Н | Н |
| Be2+ | Р | [Н] | Н | Р | Р | Р | Р | Н | Н | — | — | Р |
| Ca2+ | Р | Н | Н | Р | Р | Н | Р | М | Н | М | М | М |
| Cd2+ | Р | [Н] | Н | Р | Н | М | Р | Н | Н | Н | М | Р |
| Co2+ | Р | [Н] | Н | Р | Н | Р | Р | Н | Н | Н | Н | Р |
| Cr3+ | Р | — | Н | Р | Н | Н | Р | Н | Н | — | — | Р |
| Cu2+ | Р | [Н] | Н | Р | Н | Р | — | Н | Н | Н | — | Р |
| Fe2+ | Р | [Н] | М | Р | — | Н | Р | Н | Н | Н | Н | Р |
| Fe3+ | Р | — | Н | Р | Р | Н | — | Н | Н | — | — | Р |
| Ga3+ | Р | — | Н | Р | Р | Н | Н | Н | Н | — | — | Р |
| Hg2+ | М | [Н] | Н | Р | Н | М | Н | — | Н | Н | Н | — |
| In3+ | Р | [Н] | Н | Р | — | М | Р | Н | Н | Н | — | Р |
| La3+ | Р | [Н] | Н | Р | Н | Н | Р | Н | Н | — | — | Р |
| Li+ | Р | М | Р | Р | Р | М | Р | Р | Н | Р | Р | Р |
| Mg2+ | Р | М | Н | Р | Р | Н | Р | Н | Н | Н | М | Р |
| Mn2+ | Р | [Н] | Н | Р | Р | Р | Р | Н | Н | Н | — | Р |
| Ni2+ | Р | [Н] | Н | Р | Н | Р | Р | Н | Н | Н | Н | Р |
| Рb2+ | М | [Н] | Н | М | Н | Н | М | Н | Н | Н | Н | Н |
| Sc3+ | Р | [Н] | М | Р | Р | Н | Р | Н | Н | — | Н | Р |
| Sn2+ | Р | — | М | Р | Н | Р | М | Н | Н | Н | — | Р |
| Sr2+ | Р | Н | Н | Р | Н | Н | Р | М | Н | М | Н | Н |
| Tl+ | М | М | М | М | Н | Р | Н | Р | Н | Н | Н | М |
| Y3+ | Р | [Н] | Н | Р | — | Н | Р | Н | Н | — | — | Р |
| Zn2+ | Р | [Н] | М | Р | Н | М | Р | Н | Н | Н | М | Р |
Условные обозначения: Р – растворимое вещество (> 0,1 моль/л); М – малорастворимое (0,001–0,1 моль/л); Н – нерастворимое (< 0,001моль/л); [Н] – из раствора выпадает осадок оснóвной соли и выделяется CO2; — – вещество разлагается водой или не существует.
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ.
1. В простых веществах степени окисления равны нулю, например, Сu0.
2. Некоторые элементы в сложных веществах и в ионах имеют, как правило, постоянные степени окисления, в частности:
а) у элементов I (исключения - Cu+2, Au+3), II и III групп (см. табл.1) степень окисления, как правило, равна номеру группы со знаком “+”, например, K+1NO3, Be+2SO4, Al+3F3;
б) у H степень окисления, как правило, равна +1, например, H+1Br;
в) у O степень окисления, как правило, равна -2, например, CCl2O-2;
г) у F степень окисления всегда равна -1, например, HF-1.
3. У атомов кислотных остатков в солях степени окисления такие же как в кислотах, например, в хлоридах MCl x – степень окисления хлора -1, Cl-1; в сульфатах M a (SO4) b – степень окисления серы +6, S+6; в нитратах M(NO3) x – степень окисления азота +5, N+5.
4. Сумма степеней окисления всех атомов в молекуле равна нулю.
Таблица 15. Электронные уравнения электродных процессов, протекающих при электролизе водных растворов электролитов состава M b An c, наинертных электродах
| на катоде | на аноде |
| 2H2O + 2 e = H2 + 2OH- (при e 0 < -1,6 В) | 2An- - 2 e = An2 (при An = Br, Cl, I) |
| An2- - 2 e = An (при An = S, Se, Te) | |
 M x + + xe = M
2H2O + 2 e = H2 + 2OH-
(при -1,6 В < e 0 < -0,15 В) M x + + xe = M
2H2O + 2 e = H2 + 2OH-
(при -1,6 В < e 0 < -0,15 В)
| 2H2O - 4 e = O2 + 4H+ (при An = AsO4, CO3, ClO4, F, PO4, NO3, SO4, SeO4) |
| M x + + xe = M (при e 0 > -0,15 В) | 4OH- - 4 e = O2 + 2H2O (при An = OH) |
Примечание. e 0 – стандартный потенциал металла M, В; An – кислотный остаток или OH.
Таблица 16. Стандартные потенциалы металлов е 0 при 298 К
| M x + /M | e 0, В | M x + /M | e 0, В | M x + /M | e 0, В | M x + /M | e 0, В |
| Ac3+/Ac | -2,600 | Со2+/Со | -0,277 | La3+/La | -2,522 | Rb+/Rb | -2,925 |
| Al3+/Аl | -1,662 | Сr2+/Cr | -0,913 | Li+/Li | -3,045 | Rh3+/Rh | +0,800 |
| Ag+/Аg | +0,799 | Сu2+/Сu | +0,337 | Mg2+/Mg | -2,363 | Ru2+/Ru | +0,450 |
| Аu3+/Аu | +1,498 | Fе2+/Fе | -0,440 | Мn2+/Мn | -1,180 | Sb3+/Sb | +0,240 |
| Ва2+/Ва | -2,906 | Ga3+/Ga | -0,560 | Nа+/Nа | -2,711 | Sc3+/Sc | -2,077 |
| Ве2+/Ве | -1,847 | Н+/Н2 | 0,000 | Ni2+/Ni | -0,250 | Sn2+/Sn | -0,136 |
| Вi3+/Bi | +0,214 | Нg2+/Нg | +0,854 | Рb2+/Рb | -0,126 | Sr2+/Sr | -2,888 |
| Са2+/Са | -2,864 | In3+/In | -0,343 | Pd2+/Pd | +0,915 | Тl+/Тl | -0,336 |
| Сs+/Сs | -2,923 | Ir3+/Ir | +1,000 | Pt2+/Pt | +0,963 | Y3+/Y | -2,372 |
| Cd2+/Cd | -0,403 | K+/K | -2,924 | Rа2+/Rа | -2,916 | Zn2+/Zn | -0,763 |