1. Диаграмма энергетических уровней
Согласно Бору, атом водорода состоит из положительно заряженного ядра, масса которого в  раз превосходит массу электрона (это ядро принято называть протоном), и единственного электрона, обращающегося вокруг ядра по системе круговых орбит. Радиус наименьшей из них составляет
раз превосходит массу электрона (это ядро принято называть протоном), и единственного электрона, обращающегося вокруг ядра по системе круговых орбит. Радиус наименьшей из них составляет  ; радиусы остальных, более удаленных орбит относятся к радиусу первой как квадраты целых чисел
; радиусы остальных, более удаленных орбит относятся к радиусу первой как квадраты целых чисел 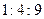 . В обычных условиях электрон находится всегда в основном состоянии – на низшей орбите с
. В обычных условиях электрон находится всегда в основном состоянии – на низшей орбите с  и наименьшим радиусом, здесь электрон имеет также наименьшую потенциальную и кинетическую энергии.
и наименьшим радиусом, здесь электрон имеет также наименьшую потенциальную и кинетическую энергии.
Если бы мы попытались изобразить модель атома Бора в масштабе, мы столкнулись бы с трудностями, так как величина радиусов орбит быстро возрастает. Поэтому более наглядной и доступной для обозрения является схема, в которой изображены не радиусы круговых орбит, а соответствующие им уровни энергии. За нулевой уровень принимается энергия, соответствующая ионизованному (свободному) состоянию электрона при  . Основному состоянию с
. Основному состоянию с  ставят в соответствие энергию, равную
ставят в соответствие энергию, равную 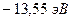 ; тогда следующие уровни располагаются как ступеньки лестницы, причем с ростом
; тогда следующие уровни располагаются как ступеньки лестницы, причем с ростом 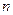 они все более сближаются. Наивысшая ступенька соответствует
они все более сближаются. Наивысшая ступенька соответствует  . Квантовый скачок электрона в это состояние соответствует его уходу на бесконечное расстояние от ядра. Практически это означает полное высвобождение электрона из атома, причем атом становится ионом. В состоянии иона атом пребывает до тех пор, пока ему не представляется возможность «поймать» другой электрон и вновь стать полноценным атомом.
. Квантовый скачок электрона в это состояние соответствует его уходу на бесконечное расстояние от ядра. Практически это означает полное высвобождение электрона из атома, причем атом становится ионом. В состоянии иона атом пребывает до тех пор, пока ему не представляется возможность «поймать» другой электрон и вновь стать полноценным атомом.

2. Объяснение правила квантования электронных орбит
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования. Это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах частиц. Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты.

В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн  , т. е.
, т. е.  . Подставляя в это соотношение длину волны де Бройля
. Подставляя в это соотношение длину волны де Бройля  , где
, где  – импульс электрона, получим:
– импульс электрона, получим:  или
или  . Таким образом, боровское правило квантования связано с волновыми свойствами электронов.
. Таким образом, боровское правило квантования связано с волновыми свойствами электронов.
3. Трудности теории Бора
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой – основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия – одного из простейших атомов, непосредственно следующего за атомом водорода.
4. Принцип соответствия
Представление о дискретных состояниях противоречит классической физике. Поэтому возник вопрос, не опровергает ли квантовая теория законы классической физики. Квантовая физика не отменила фундаментальных классических законов сохранения энергии, импульса, электрического разряда и т. д. Согласно сформулированному Н. Бором принципу соответствия, квантовая физика включает в себя законы классической физики, и при определенных условиях можно обнаружить плавный переход от квантовых представлений к классическим. Это можно видеть на примере энергетического спектра атома водорода. При больших квантовых числах  дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, характерного для классической физики.
дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, характерного для классической физики.