Перманганатометрическое титрование основано на реакциях окисления восстановителей ионом перманганата чаще всего
в кислой среде в присутствии серной кислоты. Восстановление MnO4– до Mn2+ протекает с присоединением пяти электронов по реакции:
MnO4– +8H+ +5e Mn2+ + 4H2O;
В нейтральной или слабо щелочной среде восстановление перманганат-ионов до МnO2 протекает по уравнению:
MnO4– + 2H2O + 3e MnO2 + 4OH–;
Индикатором в перманганатометрии служит титрант, так как перманганат-ионы окрашивают бесцветные растворы в слабо-розовый цвет.
В количественном анализе перманганатометрически определяют:
1) прямым титрованием — восстановители
2) обратным титрованием — окислители
3) методом замещения или обратного титрования определяют катионы Ca2+, Ba2+, Pb2+ и др.
Количественное определение перекиси водорода. 10 мл препарата помещают в мерную колбу емкостью 100 мл и доводят объем раствора водой до метки. К 10 мл полученного раствора прибавляют 5 мл разведенной серной кислоты и титруют 0,1 н. раствором перманганата калия до слабо розового окрашивания.
2KMnO4+5H2O2+3H2SO4->2MnSO4+K2SO4+8H2O+5O2
Количественное определение натрия нитрита.
5NaNO2+2KMnO4+3H2SO4->5NaNO3+2MnSO4+K2SO4+3H2O
Избыток перманганата калия определяют йодометрически
2KMnO4+10KY+8H2SO4->5Y2+6K2SO4+2MnSO4+8H2O
Y2+2N2S2O3->2NaY+Na2S4O6
5. Йод и лекарственные формы, его содержащие.Требования к качеству и методы анализа йода и раствора йода спиртового 5%
Йод.
Практически во всех химических взаимодействиях йод проявляет окислительные свойства. Исключение составляют реакции, в которых йод взаимодействует с сильными окислителями – молекулярный хлор, калия перманганат и др. При этом образуются соединения, в которых атомы йода имеют положительную СО – йодмонохлорид, гипойодиты и йодаты. Как и другие галогены, йод диспропорционирует в р-рах щелочей.
Подлинность йода подтверждают р-цией водных растворов ЛВ с крахмалом, в результате которой образуется синее окрашивание.
Для определения примесей нерастворимых и окрашенных веществ к указанной в НД навеске растертого йода добавляют р-р с избыточным по отношению к ЛВ количеством натрия тиосульфата. Получившийся р-р должен быть прозрачным и бесцветным.
В соответствии с НД йод не должен содержать примесей йодистого циана. Наличие такой примеси определяют в неск этапов по образованию берлинской лазури – гексацианферрат (II) железа (III).
Вначале йод обесцвечивают р-ром кислоты сернистой:
I2 + H2SO3 + H2O → H2SO4 + 2HI.
Затем проводят р-цию образования берлинской лазури. Для этого прибавляют 1 каплю р-ра железа (II) сульфата, 1 каплю железа(III) хлорида и 0,5 мл р-ра натрия гидроксида. Смесь слабо нагревают и подкисляют кислотой хлооводородной разведенной. Появление синего окрашивания свидетельствует о наличии в ЛВ примеси йодистого циана:
ICN + 2NaOH → NaCN + NaOI + H2O;
6NaCN + FeSO4 → Na2[Fe(CN)6] + Na2SO4;
3Na4[Fe(CN)6] + Fe4[Fe(CN)6]3↓ + 12NaCl.
Для определения примеси хлоридов йод предварительно обесцвечивают р-ром кислоты сернистой. Далее к полученному р-ру добавляют в избыточном кол-ве по отношению к кислоте сернистой р-р аммиака и изб по отношению к галогенидам р-ра серебра нитрата. В среде аммиака серебра йодид и серебра бромид выпадают в осадок, а серебра хлорид растворяется с образованием комплексного соединения [Ag(NH3)2]Cl –серебра диамминохлорида. После фильтрования к бесцветному фильтрату добавляют избыток кислоты азотной конц. При наличии хлоридов появляется муть из-за образования нерастворимого в среде кислоты азотной серебра хлорида:
[Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4NO3.
В соответствии с требованиями НД, содержание хлоридов не должно превышать 0,02%.
Количественно йод определяют титрованием р-ра ЛВ (в прис калия йодида для лучшего растворения йода) стандартным р-ром натрия тиосульфата:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
В качестве индикатора используют крахмал, поэтому титрование ведут до обесцвечивании р-ра.
Спиртовые р-ры йода.
Количественное определение йода в препарате проводят титрованием навески стандартным р-ром натрия тиосульфата.
5% р-р йода более устойчив при хранении, т.к. его готовят на разбавленном (до 46%) спирте с добавлением калия йодида. При количественном анализе данных р-ров определяют содержание как йода, так и и калия йодида. Сначала навеску препарата титруют 0,1М р-ром натрия тиосульфата для определения йода. Далее сумму йодидов оттитровывают стандартным р-ром серебра нитрата (индикатор – натрия эозинат):
NaI + AgNO3 → AgI↓ + NaNO3;
KI + AgNO3 → AgI↓ + KNO3
Разность между объемами р-ра серебра нитрата и натрия тиосульфата включают в расчет содержания калия йодида:
X(%) = 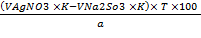
ЛС группы галогенидов.
Кислота хлористоводородная разведенная. Описание. Бесцветная прозрачная жидкость кислой реакции. Количественное определение. Кислотно-основное титрование. Метод алкалиметрии(индикатор - метиловый оранжевый). Хранение. Список Б. В склянках с притертыми пробками.
Натрия фторид. Бесцветные кристаллы или белый кристаллический порошок. Растворим в воде.
Натрия и калия хлориды. Белые кубические кристаллы или белый кристаллический порошок без запаха, соленого вкуса. Растворимы в воде. Количественное определение проводят прямой аргентометрией - метод Мора. Титруют в нейтральной среде раствором нитрата серебра. Индикатор- хромат калия. Хранение в хорошо укупоренной таре.
Натрия и калия бромиды. Белые кристаллические порошки. Хорошо растворимы в воде. Количественное определение – метод Мора.
Натрия и калия йодиды. Бесцветные или белые кристаллич порошки. Гигроскопичны. Количественное определение:прямаяаргентометрия с применением адсорбционного индикатора (метод Фаянса). Инд- натрия эозионат
Подлинность: подлинность всех препаратов подтверждается реакциями на ионы:
Na+: 1.Окрашивает пламя в желтый цвет
2. Na+ + [Sb(OH)6]- = Na[Sb(OH)6] бел осад
К+: 1. 2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] (желтый осад)
1. К+ + (OH)CH(COOH)-(OH)CH(COOH) = (OH)CH(COOH)-(OH)CH(COOK)бел ос + H+
Cl-: Cl- + AgNo3 = AgClбел ос + NO3- (над стрелочкойHNO3)
AgCl +2NH3 = [Ag(NH3)2]Cl
[Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3
HCl: 1 Реакция на Сl-
2 pHсильнокислая (по индикат бумаге)
3 HCl + MnO2 = CL2зеленый газ + MnCl2 + H2O
I-: 1. I- + AgNo3 = AgIжелтос + NO3-(надстрелочкойHNO3)
2.. I- + NaNo2 + H2SO4 = I2 + NO + H2O + Na2SO4
3. I- + FeCL3 = FeCl2 + I2 + Cl-
Br- 1. Br- + AgNo3 = AgBr желтoватый ос + NO3-(над стрелочкойHNO3)
2 HCl + C6H5-SO2-N(Na)Cl = C6H5-So2-NH2 + NaCl + Cl2
CL2 + KBr = KCL + Br2 (в эфире – бурое окрашивание)
F- 1) 2F- + CaCl2 = CaF2 (бел ос) + 2CL-
2) 6NaF + Fe(SCN)3 (красн) = Na3[FeF6] + 3NaSCN раствор обесцвечивается
3) F- + 