Уравнение состояния идеального газа. Опытные газовые законы.
В МКТ используют идеализированную модель идеального газа.
Идеальный газ - это газ, молекулы которого можно рассматривать как материальные точки, а их взаимодействие носит характер абсолютно упругого удара. (при низком р и высокой Т реальные газы приближаются к идеальным).
Состояние некоторой массы газа определяется тремя термодинамическими параметрами: р,V,T.
Давление газа представляет собой результат ударов молекул газа о стенки сосуда, в котором газ находится.
[ р ]=1Па, [ V ]= 1м3.
В соответствии с решением XI Генеральной конференции по мерам и весам (1960 г.) применяют две температурные шкалы - термодинамическую (Кельвина) и Международную практическую (Цельсия).
За 0°С принята температура замерзания воды при р =1 атм. За 0 К принята температура, при которой должно прекратиться хаотическое движение молекул. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Градус Кельвина равен градусу Цельсия.
Т= t°С+ 273, DT=Dt°.
Между параметрами газа существует определенная связь, называемая уравнением состояния. Уравнение, связывающее параметры состояния идеального газа, называется уравнением состояния идеального газа или уравнением Клапейрона:
 . (1)
. (1)
Для данной массы идеального газа отношение произведения давления на объем к абсолютной температуре есть величина постоянная.
Определим значение константы  для определенного количества идеального газа, а именно для одного моля.
для определенного количества идеального газа, а именно для одного моля.
Согласно закону Авогадро 1 моль любого газа при нормальных условиях (Т0 =273 К, р0 =105 Па) имеет VМ = 22,4×10-3 м3.
Для одного моля

 - молярная газовая постоянная.
- молярная газовая постоянная.
Для произвольной массы газа

 уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
Уравнение (1) объединяет в себе три частных случая, три эмпирических закона для изопроцессов, т.е. процессов, при которых один из параметров остается постоянным.
1. Т = const – изотермический процесс,
 или
или  -
-
закон Бойля-Мариотта:  для данной массы идеального газа при Т = const произведение давления на объем есть величина постоянная.
для данной массы идеального газа при Т = const произведение давления на объем есть величина постоянная.
Графики зависимости между параметрами состояния газа при Т =const представлены на рис. 1.
2.  р = const – изобарный процесс,
р = const – изобарный процесс, 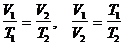 или
или 
 -
-
закон Гей-Люссака: для данной массы идеального газа при р =const объем прямо пропорционален абсолютной температуре.
Графики зависимости между параметрами состояния газа при р =const представлены на рис. 2.
3.  V=const – изохорный процес с,
V=const – изохорный процес с,  или
или  - закон Шарля: для данной массы идеального газа при V =const давление прямо пропорционально абсолютной температуре.
- закон Шарля: для данной массы идеального газа при V =const давление прямо пропорционально абсолютной температуре.
Графики зависимости между параметрами состояния газа при V =const представлены на рис. 3.
Основное уравнение МКТ идеальных газов.
Основное уравнение МКТ связывает параметры состояния газа с характеристиками движения его молекул. Давление газа на стенки сосуда есть следствие бесчисленных столкновений молекул газа со стенками. Средняя сила, возникающая от совокупного действия всех молекул газа, определяет давление газа.
Представим себе сосуд в виде прямоугольного параллелепипеда, в котором содержится идеальный газ (рис.4).Вычислим давление газа на одну из стенок сосуда площадью S.
Рассмотрим удар одной молекулы, которая до удара двигалась перпендикулярно стенке. Согласно закону сохранения импульса
 ,
,
 ,
,
 изменение импульса стенки вследствие удара одной молекулы.
изменение импульса стенки вследствие удара одной молекулы.
За время Dt площадки S достигнут только те молекулы, которые заключены в объеме параллелепипеда с основанием S и высотой  . Необходимо учитывать, что реально молекулы движутся к площадке S под разными углами. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трёх взаимно перпендикулярных направлений, так что вдоль каждого из них движется 1/3 молекул, причем половина молекул (1/6) движется вдоль данного направления в одну сторону, половина - в противоположную.
. Необходимо учитывать, что реально молекулы движутся к площадке S под разными углами. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трёх взаимно перпендикулярных направлений, так что вдоль каждого из них движется 1/3 молекул, причем половина молекул (1/6) движется вдоль данного направления в одну сторону, половина - в противоположную.

 концентрация молекул, их число в единице объема.
концентрация молекул, их число в единице объема.
За время Dt изменение импульса стенки составит
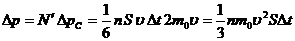
Т.к. 
 - сила, с которой молекулы воздействуют на стенку, а давление, обусловленное этой силой, т.е. давление газа, равно
- сила, с которой молекулы воздействуют на стенку, а давление, обусловленное этой силой, т.е. давление газа, равно
 . (2)
. (2)
Если в объеме V содержится N молекул, движущихся со скоростями  , то целесообразно рассматривать среднюю квадратичную скорость, характеризующую всю совокупность молекул газа:
, то целесообразно рассматривать среднюю квадратичную скорость, характеризующую всю совокупность молекул газа:
 . (3)
. (3)
Уравнение (2) и учетом (3) примет вид:
 - основное уравнение МКТ.
- основное уравнение МКТ.

где  - средняя кинетическая энергия поступательного движения одной молекулы.
- средняя кинетическая энергия поступательного движения одной молекулы.
Поскольку 

Выразим  через параметры газа. Для этого сопоставим уравнение Менделеева-Клапейрона и уравнение МКТ.
через параметры газа. Для этого сопоставим уравнение Менделеева-Клапейрона и уравнение МКТ.

 ,
,
 ,
,
 ,
,
т.к. 
 ,
,
где  - постоянная Больцмана;
- постоянная Больцмана;
 .
.
Таким образом, абсолютная температура есть мера средней кинетической энергии молекул.
Получим ещё одно выражение для давления:
 .
.