Взаимодействие перманганата калия с органическими веществами в различных средах.
Алкены
1. Реакция Вагнера-окисление перманганатом калия в нейтральной или слабощелочной среде. Образуются диолы (гликоли)
R-СН=СН-R + КМnО4 + Н2О (КОН)→ R-CH(OH)-CH(OH)-R + МnО2 ↓ +КОН (К2МnО4)
но!!! R-СН=СН2 + КМnО4 +(Н2О) (t) → RCH2COOK +К2СО3 + КОН + МnО2 ↓ + Н2О
2. Жесткое окисление
-этилен + КМnО4 +Н2SО4→2СО2 + МnSО4 +К2SО4+Н2О
-симметричный алкен:R-СН=СН-R + КМnО4 +Н2SО4→2R-СООН + МnSО4 +К2SО4+Н2О
-несимметричный алкен:R-CH=CH-CH2-R + КМnО4 +Н2SО4→R-COOH +R-CH2COOH + МnSО4 +К2SО4+Н2О
-двойная связь у крайнего атома углерода:СН2=СН-R + КМnО4 + Н2SО4→СО2 +R-СООН +…..
-наличие радикала:R-С(СН3)=СН-R + КМnО4 +Н2SО4→R-CO-CH3 +R-СООН +….
-наличие двух радикалов:R-С(СН3)=С(СН3)-R + КМnО4 + Н2SО4→R-СО-СН3 +R-СО-СН3 +…
Циклоалканы.
Циклопропан не взаимодействует с водным раствором перманганата калия. Все остальные циклоалканы сравнительно легко окисляются, образуя двухосновные карбоновые кислоты с тем же числом углеродных атомов:
Циклобутан + КМnО4 + Н2SО4→ СООН-СН2-СН2-СООН (янтарная) + МnSО4 +К2SО4+Н2О
Циклогексан + КМnО4 + Н2SО4→ СООН-СН2-СН2-СН2-СН2-СООН (адипиновая) + МnSО4 +К2SО4+Н2О
Диеновые УВ.
диен + КМnО4 + Н2О (КОН)→ тетраол + МnО2 +КОН (К2МnО4)
дивинил + КМnО4 +Н2SО4→ 20 СО2 + МnSО4 +К2SО4+Н2О аллен + КМnО4 +Н2SО4→15СО2 + МnSО4 +К2SО4+Н2О
изолированные диены с концевыми двойными связями + КМnО4 +Н2SО4 →СООН-(СН2)n-СООН +2СО2 + МnSО4 +К2SО4+Н2О
Алкины

 1. Ацетилен окисляется до щавеливой (этандиовой) кислоты или ее солей (оксалатов): Н+ Mn2+ (бесцветный р-р)
1. Ацетилен окисляется до щавеливой (этандиовой) кислоты или ее солей (оксалатов): Н+ Mn2+ (бесцветный р-р)
СН≡СН + КМnО4 + Н2SО4→СООН-СООН + К2SО4 + МnSО4 +Н2О Н2О

 СН≡СН + КМnО4 +КОН (Н2О)→СООК-СООК + К2МnО4 (МnО2 +КОН) КMnО4 MnО2 ↓(коричневый) 2. Симметричный алкин: OH-
СН≡СН + КМnО4 +КОН (Н2О)→СООК-СООК + К2МnО4 (МnО2 +КОН) КMnО4 MnО2 ↓(коричневый) 2. Симметричный алкин: OH-
 R-С≡С-R + КМnО4 +Н2SО4→2R-СООН + К2SО4 +МnSО4 +Н2О MnО42- (зеленый р-р)
R-С≡С-R + КМnО4 +Н2SО4→2R-СООН + К2SО4 +МnSО4 +Н2О MnО42- (зеленый р-р)
КОН (Н2О)→2R-СООК + К2МnО4 (МnО2 ↓ +КОН)
3. Несимметричный алкин (связь не у крайнего атома углерода)
R-С≡С-СН2-R + КМnО4 +Н2SО4→RCOOH + R-CH2COOH+ K2SO4 + MnSO4+H2O
KOH (H2O)→ RCOOK +RCH2COOK + К2МnО4 (МnО2 ↓ + КОН)
4.Если тройная связь находится у крайнего атома углерода, образуется СО2 и кислота, либо соли:
СН≡С-R + КМnО4 +H2SO4→CO2+RCOOH +K2SO4+MnSO4+H2O
KOH (H2O)→K2CO3+RCOOK+ К2МnО4 (МnО2 ↓ + КОН)
Арены.
Бензол стоек к действию окислителей- с перманганатом калия не взаимодействует!
С6Н6+ О2 (V2О5,4000) → 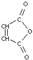 (малеиновый ангидрид)+ CО2 +Н2О
(малеиновый ангидрид)+ CО2 +Н2О
1. Толуол:
С6Н5СН3 + КМnО4 +H2SO4→C6H5-COOH + K2SO4+ MnSO4 +H2O
С6Н5СН3 + КМnО4 +KOH (H2O)→C6H5COOK +K2MnO4(МnО2 ↓ +KOH) или С6Н5СН3 + K2Cr2O7 +H2SO4 →C6H5-COOH + K2SO4+ Cr2(SO4)3
2.Стирол:
С6H5-CH=CH2 + КМnО4 +H2SO4→C6H5-COOH + CO2 +MnSO4+K2SO4+H2O
С6H5-CH=CH2 + КМnО4 + KOH (H2O)→1-фенилэтандиол-1,2+ К2МnО4 (МnО2 ↓ +КОН)
3. Другие гомологи бензола:
окисление идет по α-углеродному атому с образованием бензойной кислоты и соответствующей карбоновой кислоты, если среда кислая. Если среда щелочная или нейтральная, то образуется соль бензойной кислоты и соль карбоновой кислоты.
Спирты.
1. Первичные спирты: в кислой среде образуют карбоновые кислоты при окислении перманганатом калия, а в щелочной и нейтральной- соли карбоновых кислот: R-CH2-OH + КМnО4 +H2SO4→R-COOH + MnSO4+K2SO4
KOH (H2O)→RCOOK + К2МnО4 (МnО2 ↓ +KOH)
2. Дихромат калия в кислой среде окисляет первичные спирты при t до альдегидов, а на холоду до карбоновых кислот:
R-CH2-OH + K2Cr2O7 +H2SO4 (t)→R-COH + Cr2(SO4)3 +K2SO4 +H2O
или R-COОH + Cr2(SO4)3 +K2SO4 +H2O
3.Вторичные спирты образуют при окислении в основном кетоны:
R-CH(OH)-R + КМnО4 +H2SO4→R-CO-R + K2SO4+MnSO4+H2O
4. Особые свойства метанола: при окислении первоначально образуется муравьиная кислота, в которой имеется легко окисляемая альдегидная группа, поэтому конечным продуктом окисления является углекислый газ, если среда кислая, либо карбонат калия, если среда нейтральная или щелочная.
Альдегиды.
1.В кислой среде образуются карбоновые кислоты, в щелочной или нейтральной-соли карбоновых кислот:
R-COH + КМnО4 +H2SO4→R-COOH +MnSO4+K2SO4+H2O
KOH →R-COOK + К2МnО4!!! Но в нейтральной среде:3R-COH +2 КМnО4 →R-COOH +2 R-COOК+2 МnО2 ↓ +H2O
2.Дихромат калия в кислой среде:
R-COH + K2Cr2O7 +H2SO4 →R-COOH +K2SO4 + Cr2(SO4)3 +H2O
3. Формальдегид имеет две альдегидные группы: окисляется до углекислого газа, если среда кислая, либо карбонат (гидрокарбонат) калия, если среда щелочная или нейтральная.
Карбоновые кислоты:
Метановая кислота всегда окисляется до углекислого газа, если среда кислая, либо до карбоната калия, если среда щелочная или нейтральная.
Названия и формулы некоторых органических веществ. Некоторые специфические р-и
| тривиальные | международные | формула | Пиролиз метана: 2СН4(15000С) →С2Н2 + 3Н2 |
| аланин | 2-аминопропановая к-та | СН3СН(NН2)СООН | |
| аллен | пропадиен | СН2=С=СН2 | |
| аллил | пропенил | СН2=СН-СН2- | Конверсия метана: СН4 + Н2О(пар)→СО +3Н2 или СН4 + СО2→2СО +Н2 |
| аллиловыйц спирт | пропен-2-ол-1 | СН2=СН-СН2ОН | |
| амил | пентил (радикал) | С5Н11- | |
| амиилен | пентен | С5Н10 | |
| амиловый спирт | пентанол | С5Н11ОН | |
| анилин | фениламин | С6Н5-NН2 | |
| ацетон | пропанон (диметилкетон) | СН3-СО-СН3 | Пиролиз кальциевых (бариевых) солей карбоновых кислот – получаются кетоны: 3500С (СН3СОО)2Са→СН3СОСН3 +СаСО3 |
| акриловая кислота | Пропеновая (акрилат) | СН2=СН-СООН | |
| ацетальдегид | этаналь | СН3-СНОН | |
| амиловый спирт | пентанол | С5Н11ОН | |
| бензиловый спирт | фенилметанол | С6Н5-СН2ОН | |
| болотный газ | метан | СН4 | Ацилирование - реакции замещения водорода спиртовой или аминогруппы на остаток карбоновой кислоты (ацил): RCO- В качестве ацилирующих агентов используют галогенангидриды и ангидриды кислот. |
| валин | 2-амино-3-метилбутановая к-та | СН3СН(СН3)СН(NН2)СООН | |
| винил | этенил | СН2=СН- | |
| валериановая к-та | пентановая кислота (валеринат) | СН3-(СН2)3-СООН | |
| винный спирт | этанол | С2Н5ОН | |
| гидрохинон | 1,4-дигидроксибензол | С6Н4(ОН)2 | |
| глицерин | пропантриол-1,2,3 | СН2(ОН)-СН(ОН)-СН2(ОН) | |
| глицин,гликокол | аминоуксусная кислота | Н2N-СН2-СООН | Алкилирование - реакции, приводящие к замещению водорода гидроксильной, карбоксильной или аминогруппы на алкильную группу |
| глутаминовая к-та | 2-аминопентандиовая к-та | НСООН(СН2)2СН(NН2)СООН | |
| дивинил | бутадиен-1,3 | СН2=СН-СН=СН2 | |
| древесный спирт | метанол | СН3ОН | |
| изопрен | 2-метилбутадиен-1,3 | СН2=С(СН3)-СН=СН2 | |
| ксилол | диметилбензол | С6Н4(СН3)2 | Аммонолиз - обменное разложение органических соединений с участием аммиака, например: СН3СН(Cl)СООН+ 2NН3→ СН3СН(NН2)СООН+ NН4Cl |
| карболовая кислота | фенол (фенолят) | С6Н5ОН | |
| крезол | метилфенол | С6Н4ОН(СН3) | |
| кумол | изопропилбензол | С6Н5-СН(СН3)2 | |
| лизин | 2,6-диаминогексановая кислота | NН2СН2(СН2)3СН(NН2)СООН | |
| линолевая кислота | 9,12-Октадекадиеновая кислота | CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH. | |
| масляная к-та | бутановая кислота (бутират) | СН3-(СН2)2СООН | Поликонденсация- процесс получения полимеров из би- или полифункциональных соединений (мономеров), сопровождающийся выделением побочного низкомолекулярного вещества (воды, спирта, галогеноводорода и др.). |
| метакриловая | 2-метилпропановая к-та | СН2=С(СН3)-СООН | |
| муравьиная к-та | метановая кислота (формиат) | НСООН | |
| олеиновая кислота | цис-октадецен-9-овая кислота | СН3-(СН2)7СН=СН(СН2)7-СН3 | |
| пальмитиновая к-та | гексадекановая кислота | СН3-(СН2)14-СООН | |
| пикриновая кислота | 2,4,6-тринитрофенол | С6Н2(NО2)3ОН | |
| пирокатехин | 1,2-дигидроксибензол | С6Н4(ОН)2 | |
| пироксилин | тринитроцеллюлоза | [С6Н7О2(ОNО2)3] | Элиминирование — это отщепление от молекулы органического соединения атомов или атомных групп без замены их другими: -дегидратация; -дегидрогалогенирование;-дегалогенирование |
| пропаргиловый спирт | пропин-2-ол-1 | НС≡С-СН2ОН | |
| пропионовая к-та | пропановая кислота | СН3-СН2-СООН | |
| резорцин | 1,3-дигидроксибензол | С6Н4(ОН)2 | |
| стеариновая кислота | октадекановая кислота | СН3-(СН2)16-СООН | |
| стирол | винилбензол | С6Н5-СН=СН2 | |
| толуол | метилбензол | С6Н5-СН3 | |
| уксусная кислота | этановая кислота (ацетат) | СН3-СООН | |
| уксусная соль | ацетат кальция | Са(СН3СОО)2*Н2О | Реакция декарбоксилирования карбоновых кислот заключается в отщеплении от молекулы карбоновой кислоты карбоксильной группы, протекающем согласно следующей схеме: R-C(O)OH → R-H + CO2 |
| формальдегид | метаналь | НСОН | |
| хлоропрен | 2-хлорбутадиен-1,3 | СН2=С(Сl)-СН=СН2 | |
| хлороформ | трихлорметан | СНСl3 | |
| четыреххлористый углерод | тетрахлорметан | ССl4 | |
| щавеливая кислота | этандиовая кислота (оксалат) | СООН-СООН | |
| этиленгликоль | этандиол-1,2 | СН2(ОН)-СН2(ОН) | |
| этиленоксид | эпоксиэтан (оксид этилена) | СН2(О)СН2 |
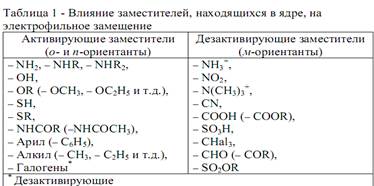 Чем выше находится заместитель, тем более сильными активирующими (дезактивирующими) свойствами он обладает.
Чем выше находится заместитель, тем более сильными активирующими (дезактивирующими) свойствами он обладает.
| Если в бензольном кольце содержатся два заместителя, то по отношению к третьему (вступающему в кольцо) заместителю они проявляет себя следующим образом: 1)если в бензольном кольце содержатся два заместителя 1-го рода, то вступление третьего заместителя контролирует тот, который обладает более сильными активирующими свойствами (см. таблицу). 2) если бензольное кольцо содержит одновременно заместители 1-го и 2-го рода, то вступление третьего заместителя контролирует заместитель 1-го рода. 3) если два заместителя (независимо от их ориентирующего влияния) находятмся в мета - положении, то стерически маловероятно, чтобы третья группа расположилась между ними. |