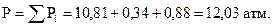Рассмотрим растворимость газов и твердых веществ в жидкостях в случае образования идеальных растворов.
1. Растворимость твердых веществ (к примеру, солей) в жидкостях. Растворение в данном случае при постоянной температуре происходит до тех пор, пока не образуется насыщенный раствор (когда кристаллы твердого вещества присутствуют в растворе, однако количество растворившегося вещества и перешедшего в твердую фазу за единицу времени одинаково). Устанавливается равновесие “твердый компонент – насыщенный раствор”, при котором
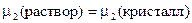 , (23)
, (23)
где m 2 — химический потенциал вещества в растворе и в кристаллической фазе.
Можно показать, что при образовании идеального раствора
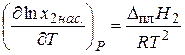 , (24)
, (24)
где x 2 — мольная доля растворенного вещества в насыщенном растворе, Dпл Н 2 — энтальпия плавления этого вещества. Уравнение (24) было впервые выведено русским физико-химиком И.Ф. Шредером и с тех пор носит его имя как уравнение Шредера.
Уравнение (24) можно преобразовать:
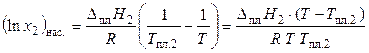 , (25)
, (25)
где Т пл.2 — температура плавления чистого кристаллического вещества.
Из уравнений (24) и (25) следует, что
— чем выше температура, тем больше растворимость твердых веществ в жидкостях, так как Dпл Н 2 > 0;
— чем выше температура плавления и теплота плавления твердых веществ, тем меньше их растворимость в жидкостях.
Растворимость твердых тел в жидкостях зависит также от давления и эту зависимость нужно учитывать, особенно в геологии, где имеют дело с сотнями и тысячами атмосфер.
Для идеальных растворов эта зависимость определяется уравнением Планка-Ван-Лаара:
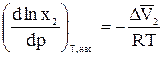 , (26)
, (26)
где 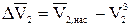 — разность парциальных мольных объёмов растворенного вещества в растворе и твердой фазе.
— разность парциальных мольных объёмов растворенного вещества в растворе и твердой фазе.
2. Раствормость газов в жидкостях. На растворимость газа в жидкости оказывает влияние давление газа. Эта зависимость будет иметь вид:
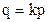 , (27)
, (27)
где q — растворимость газа, р — давление газа.
Коэффициент пропорциональности 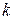 получил название коэффициента Генри, впервые систематически исследовавшего растворимость газов в жидкостях.
получил название коэффициента Генри, впервые систематически исследовавшего растворимость газов в жидкостях.
В гидрогеохимии часто используют другое уравнение, связывающее приведенный объём растворенного газа с (парциальным) давлением этого газа над раствором:
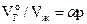 , (28)
, (28)
где 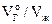 – приведенный к нормальным условиям (00С и 1атм) объём газа, растворенного в единице объёма (1л) жидкости. Коэффициент пропорциональности a получил название коэффициента абсорбции газа в жидкости или коэффициента Бунзена.
– приведенный к нормальным условиям (00С и 1атм) объём газа, растворенного в единице объёма (1л) жидкости. Коэффициент пропорциональности a получил название коэффициента абсорбции газа в жидкости или коэффициента Бунзена.
Существует также закон Сеченова: присутствие электролитов в растворе понижает растворимость газов в них.
lnC= lnC0- bC',
где С ‑ искомая растворимость газа, С ‑ концентрация раствора электролита͵ С0 ‑ растворимость газа в чистом растворителе.
Пример 5.4 В пресной воде, залегающей на глубине 200 метров и имеющей температуру 15 оС, найдены следующие газы: СH 4, CO 2 и N 2, растворимость которых в 1 л воды равна:
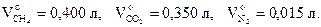
коэффициенты адсорбции этих газов при 15 оС равны
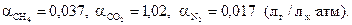
Определить парциальные давления каждого из растворенных газов.
Решение. По уравнению
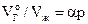 ,
, 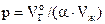
находим
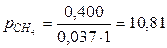 атм,
атм, 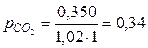 атм,
атм, 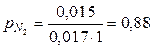 атм.
атм.
Общее давление газов в пресной воде по закону Дальтона равно