Актуализация опорных знаний.
1. Тест «Верю, не верю».
Нужно прочитать утверждения и либо согласиться с ними, либо – не согласиться. Согласие – «да», несогласие – «нет». Следует отметить «да» знаком «+», а «нет» - знаком «-».
1. Молекулы идеального газа не взаимодействуют между собой.
2. Объем идеального газа можно уменьшать до нуля.
3. С ростом давления объем идеального газа увеличивается.
4. Давление идеального газа не зависит от температуры.
5. Все газы при охлаждении уменьшаются в объёме.
1. Молекулы газа непрерывно движутся.
2. При абсолютном нуле прекращается всякое движение молекул.
3. Масса молекул идеального газа равна нулю
4. Идеальный газ нельзя охладить до абсолютного нуля.
5. При увеличении температуры давление идеального газа уменьшается.
ПРОВЕРЬТЕ СЕБЯ:
1. +
2. +
3. -
4. -
5. +
1. +
2. +
3. -
4. -
5. -
2. Дать ответы на вопросы:
1. Какие макропараметры вам известны?
2. Какое уравнение связывает между собой все три макропараметра?
3. Какие процессы называются изопроцессами? Почему?
4. Какие изопроцессы вам известны?
5. Какой процесс называют изотермическим? Почему?
6. Какой закон описывает изотермический процесс?
7. Какой процесс называют изобарным? Почему?
8. Какой закон описывает изобарный процесс?
9. Какой процесс называют изохорным? Почему?
10. Какой закон описывает изохорный процесс?
Изучение нового материала. Эксперимент
1. Экспериментальная работа в группах «Испарение различных жидкостей». На лист промокательной бумаги пробочкой, смоченной в спирте, воде, растительном масле, ученики наносят пятна и наблюдают за скоростью их высыхания.
Особенности испарения:
1. Происходит при любой температуре.
2. Происходит тем быстрее, чем выше температура, чем больше площадь испаряющейся поверхности, чем сильнее движение воздуха (ветер), чем более летучей является жидкость.
3. При испарении температура уменьшается.
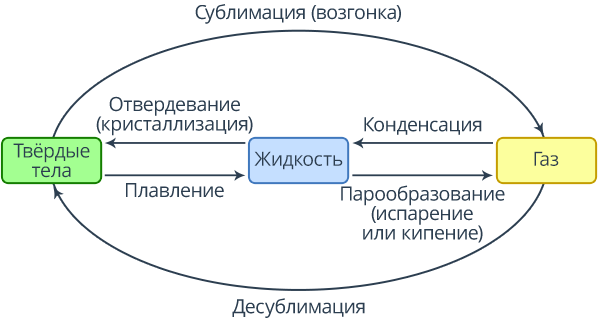
Рис. 1. Схема изменения агрегатного состояния вещества
Если жидкость превращается в пар, такой процесс называется парообразованием, обратный же процесс, переход из пара в жидкость, называется конденсацией. Схема таких преобразований представлена на рисунке 1.
Парообразование – свойство капельных жидкостей изменять свое агрегатное состояние и превращаться в пар. Парообразование делится на два вида:
1. Испарение, которое происходит с поверхности раздела жидкости и окружающего воздуха;
2. Кипение, которое происходит во всем объеме жидкости при определенных условиях.
Насыщенный пар
Как мы знаем, все молекулы жидкости находятся в состоянии непрерывного хаотического движения. Хаотичность, в частности, означает, что направление движения отдельных молекул носит случайный характер. Почему же при этом жидкость сохраняет свой объем, а не распадается на отдельные частицы? Между молекулами действуют силы притяжения, которые не позволяют им покинуть жидкость. Кроме того, очевидно, что значение скоростей молекул также случайны, а, следовательно, среди них обязательно найдутся очень быстрые молекулы. Если такая молекула вследствие хаотического перемещения окажется вблизи поверхности раздела жидкости и окружающего воздуха, то ее кинетической энергии может хватить на то, чтобы преодолеть силы притяжения и вырваться наружу (рис. 2).
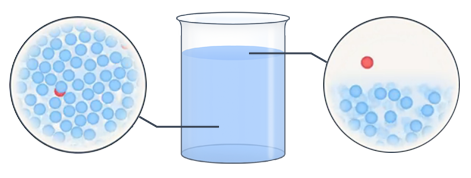
Рис. 2. Наглядное изображение поведения молекул в жидкости
Это и есть процесс испарения. Когда количество испарившихся молекул становится значительным, они образуют пар. Конечно, может произойти и обратное. Вырвавшиеся за пределы жидкости молекулы вследствие хаотического движения снова вернутся в объем жидкости, такой процесс, как мы знаем, называется конденсацией. Если сосуд с жидкостью будет открыт, то испарившиеся молекулы могут безвозвратно покидать пространство над жидкостью, в результате чего количество последней будет постепенно уменьшаться. Примеры описанного мы можем повсеместно наблюдать вокруг, все процессы высыхания именно так и происходят – жидкость испаряется, а пар обратно не конденсируется вследствие того, что молекулы этого пара удаляются от жидкости.
Если проделать простой эксперимент: наполнить стакан водой и проследить за уровнем воды в течение нескольких дней. Через несколько дней уровень воды станет значительно ниже, часть воды испарилась.
Разные жидкости испаряются с разными скоростями. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии их преодолеть и вылететь наружу и тем меньше скорость испарения. Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее – вода. Намного медленнее воды испаряются масло и ртуть.
Поскольку испарение – это уход из жидкости самых быстрых молекул, то средняя кинетическая энергия молекул, которые остались в жидкости, естественно уменьшается. А что такое средняя кинетическая энергия молекул? Это, фактически, температура, т. е. жидкость при испарении остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости, особенно при ветре, когда выходишь из воды. Вода, испаряясь по всей поверхности тела, уносит тепло. Ветер же ускоряет процесс испарения.
А что будет, если мы закроем сосуд с жидкостью? Молекулы пара уже не смогут покидать пространство над ней, по мере испарения их количество сначала будет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
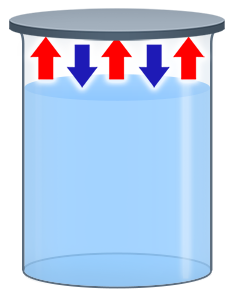 Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде).
Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде).
Т.е. в такой системе будут идти два конкурирующих процесса (рис. 3). Первый – это процесс испарения, для которого количество покидающих жидкость молекул будет определяться только температурой.
Какими параметрами определяется скорость испарения жидкости, от чего она зависит. Чтобы вырваться из объема жидкости, молекула должна преодолеть притяжение со стороны других молекул той же жидкости. Другими словами, ей необходимо совершить работу против сил межмолекулярного взаимодействия. Величина этой работы зависит от рода жидкости и носит название работы выхода. Таким образом, в парообразное состояние могут перейти те молекулы, чья кинетическая энергия превосходит значение работы выхода, это отражено в формуле: =.
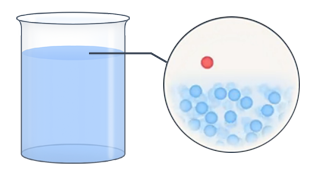
Рис. 4. Процесс испарения (процесс вылета молекулы с поверхности жидкости).
Основные факторы, которые влияют на скорость испарения жидкости:
1. Род жидкости
2. Температура жидкости
3. Скорость отвода испарившихся молекул от жидкости (вспомните: для того чтобы остудить чай, мы дуем)
4. Площадь поверхности жидкости
На примере с чаем: для того чтобы он остывал быстрее, мы наливаем его в блюдце.
Второй процесс – это процесс конденсации, в котором количество возвращающихся в жидкость молекул будет, помимо прочего, зависеть и от концентрации молекул пара: чем больше молекул пара, тем большая вероятность, что одна из них вернется в жидкость.
Вначале, пока эта концентрация невелика, количество конденсирующихся молекул за единицу времени будет, естественно, меньше количества испаряющихся молекул, т. е. молекул, покидающих жидкость. Однако по мере роста концентрации пара поток молекул пар – жидкость будет расти, а обратный поток будет оставаться прежним, ведь он определяется только температурой.
В какой-то момент оба количества молекул станут равными. Как говорят физики, в системе установится динамическое равновесие, а пар достигнет состояния так называемого насыщения. Соответственно, пар, который находится в состоянии динамического равновесия со своей жидкостью, будем называть насыщенным.
Представьте себе здание с огромным количеством дверей. Какое-то количество людей заходит в это здание, а какое-то количество людей выходит из этого здания. Если количество людей, которые входят в здание, равно количеству людей, которые выходят из здания в единицу времени, то можно сказать, что достигнуто состояние насыщения. Вот точно так же происходит и в случае с паром.
Насыщенный пар – это в некотором смысле предельное состояние пара. Имеется в виду, что значение давления этого пара и его плотности являются максимальными при данном значении температуры. В противном же случае мы будем называть пар ненасыщенным. Насыщенный пар – это пар, находящийся в динамическом равновесии со своей жидкостью. То есть количество молекул жидкости, покидающих жидкость за некий отрезок времени, в среднем равно количеству молекул пара, возвращающихся обратно в жидкость (рис. 5).
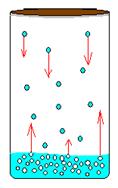 Рис.5
Рис.5
Свойства насыщенного пара
Первое свойство: при постоянной температуре плотность насыщенного пара не зависит от его объема. Понять это свойство легко. Представим себе, что мы, не меняя температуры, уменьшим объем сосуда, в котором находится насыщенный пар (рис. 6).
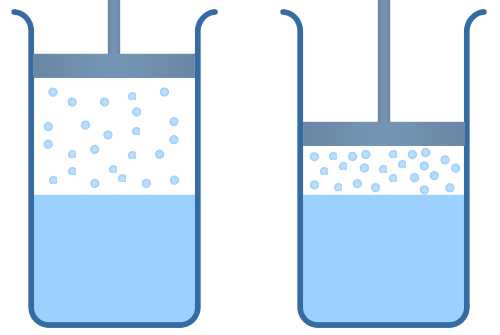
Рис. 6. Процесс сжатия пара в цилиндре (уменьшение обьема)
Количество молекул, переходящих от пара к жидкости в единицу времени, естественно, превысит количество испаряющихся молекул, но при этом часть пара просто сконденсируется, а оставшийся пар снова придет в состояние динамического равновесия. В итоге плотность этого пара будет равна начальной плотности: 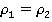
Второе свойство: давление насыщенного пара не зависит от его объема. Этот факт очевиден ввиду простой связи давления и плотности, выраженной уравнением Менделеева–Клапейрона. Как следствие, закон Бойля-Мариотта для насыщенного пара выполняться не будет.
Третье свойство: при неизменном объеме плотность насыщенного пара растет с повышением температуры. Действительно, при увеличении температуры возрастает скорость испарения жидкости. Динамическое равновесие в первый момент будет нарушено, т. е. произойдет дополнительное испарение некоторой части жидкости. Плотность пара будет возрастать до тех пор, пока динамическое равновесие вновь не восстановится.
А при охлаждении произойдет обратный процесс: часть пара сконденсируется, уменьшая его плотность.
Четвертое свойство: давление насыщенного пара растет с температурой быстрее, чем по линейному закону, как это было в случае идеального газа. В самом деле, с ростом температуры возрастает плотность насыщенного пара, а согласно уравнению Менделеева–Клапейрона давление пропорционально произведению плотности на температуру. Т. е. в случае идеального газа рост давления обуславливался только ростом температуры, теперь работают два фактора: зависимость давления насыщенного пара от температуры, что представлено участком 1-2 графика (рис. 7).
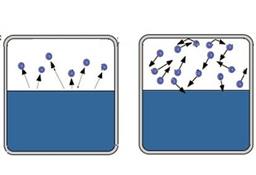
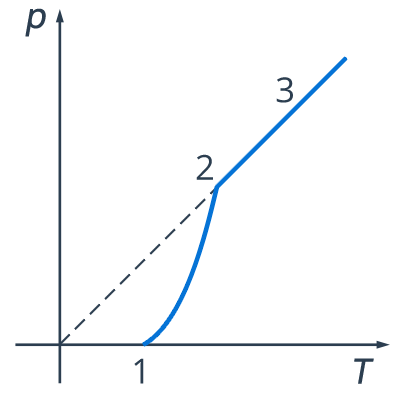
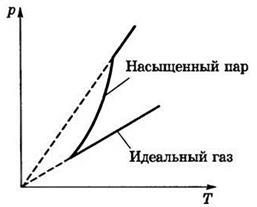
Рис. 7. График зависимости давления насыщенного пара от температуры
Эту зависимость нельзя вывести из законов идеального газа. При изохорном нагревании или охлаждении насыщенного пара его масса меняется. Поэтому закон Шарля в данном случае работать не будет.
Обратите внимание: в точке 2 вся жидкость испаряется. При дальнейшем повышении температуры пар становится ненасыщенным и его давление здесь растет как раз согласно закону Шарля. Это участок 2-3 (рис. 7).
Вспомним, что линейный рост давления идеального газа вызван ростом интенсивности ударов молекул о стенки сосудов. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще, ведь пара становится больше. Именно одновременным действием этих двух факторов и вызван нелинейный рост давления насыщенного пара на участке 1-2.
Коренным отличием насыщенного пара от идеального газа является тот факт, что он не является замкнутой системой, т. е. находится в постоянном контакте с жидкостью.
Кипение
Существует еще один вид парообразования – кипение. Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. А при нагревании внутрь этих микропузырьков начинают проникать испаряющиеся молекулы жидкости. В итоге пузырьки постепенно увеличиваются в размерах и становятся видимы невооруженным газом. В кастрюле с водой они осаждаются на дне и стенках. В течение короткого времени пар внутри пузырьков становится насыщенным, давление которого быстро растет с повышением температуры. Чем крупнее становятся пузырьки по мере роста температуры, тем больше действует на них архимедова сила, и с определенного времени начнется отрыв и всплытие пузырьков, так как архимедова сила станет больше, чем сила тяжести, действующая на пузырек. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости, пар в них конденсируется и пузырьки сжимаются. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени, вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар. Шум сменяется бурлением. Жидкость закипела.
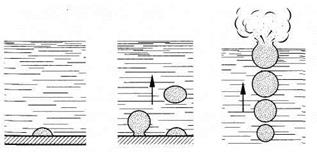
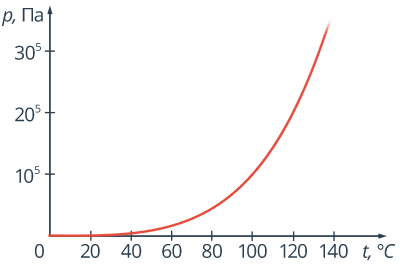
Рис. 8. Процесс кипения Рис. 9. График зависимости температуры кипения воды от давления среды
В отличие от испарения, которое происходит при любой температуре, кипение происходит только при фиксированной температуре – той температуре, которой достаточно, чтобы пузырек смог вырасти, подняться на поверхность и лопнуть.
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость, чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение (рис. 9). При нормальном атмосферном давлении, которое составляет приблизительно 100 000 Па, температура кипения воды равнаС. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуреС равно 105 Па.
Естественно, чем выше мы поднимаемся в атмосфере, тем меньше становится это атмосферное давление. Так, например, на вершине самой высокой горы Кавказа – Эльбруса – атмосферное давление составляет 5·, т. е. в 2 раза меньше, чем нормальное атмосферное давление (рис. 10). Естественно, что температура кипения там будет ниже, чем на уровне моря. Вода там закипит при температуре. Температура кипения при нормальном атмосферном давлении является строго определенной для данной жидкости величиной. (Рис.11).
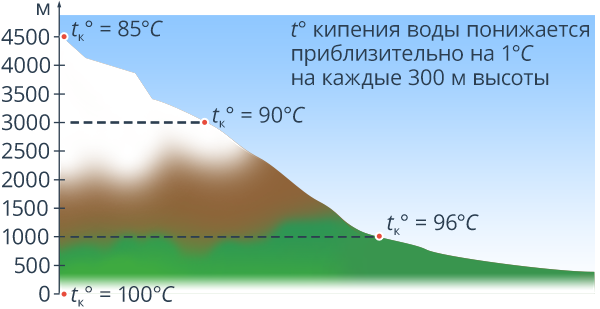
Рис. 10. Наглядное представление зависимости температуры кипения воды от изменения давления с высотой
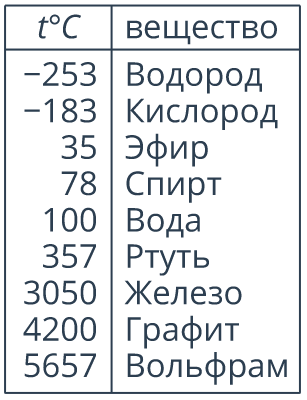
Рис. 11. Температура кипения некоторых веществ (при нормальном атмосферном давлении.)
Так, спирт кипит при С, эфир – при С, ртуть – при. Обратите внимание, чем более летучей является жидкость, тем ниже ее температура кипения. Например, кислород кипит при -С, поэтому при обычных температурах кислород – это газ.
Естественно, если увеличивать давление над жидкостью, то и температура кипения будет расти, именно этот принцип положен в основу работы так называемых скороварок. Искусственным образом над жидкостью создается повышенное давление, и вода начинает кипеть при температурах значительно больше, чем С. В этом случае продукты, которые мы хотим приготовить, например картофель, будут приготовлены значительно быстрее, чем в случае нормального атмосферного давления, отсюда и название скороварка.
Если чайник снять с огня, то кипение тут же прекратится. Процесс кипения требует непрерывного подвода тепла. Вместе с тем температура воды в чайнике после закипания перестает меняться, оставаясь равной С.
Куда же при этом девается подводимое тепло, не противоречит ли это закону сохранения энергии? Тепло идет на увеличение потенциальной энергии молекул, в данном случае на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалеку друг от друга, и жидкость будет переходить в газообразное состояние.
На рисунке 12 можно увидеть так называемую фазовую диаграмму для воды. Эта диаграмма показывает, в каком состоянии будет находиться вода при различных давлениях и температурах. Здесь отмечена критическая точка (которая соответствует критическому давлению и критической температуре).
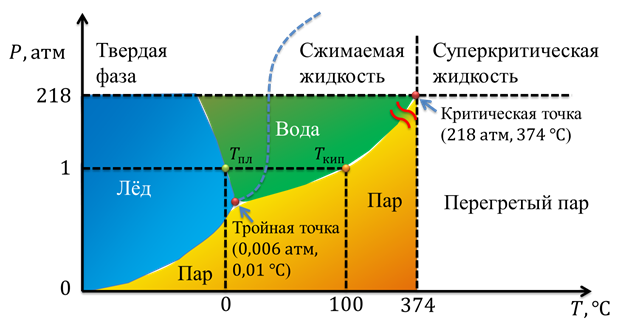 Рис.12.
Рис.12.
Если температура превышает критическую температуру, то газ невозможно сконденсировать ни при каком давлении. На диаграмме тройная точка — это точка пересечения строго определенных значений давления и температуры, при которых вода может одновременно существовать в твердом, жидком и газообразном состоянии. Такое состояние воды достижимо при очень низком давлении (порядка 0,006 от нормального атмосферного давления) и при температуре 0,01 оС.
Перегретая жидкость
Растворенные в жидкости пузырьки, а также любые другие микроскопические примеси играют роль, так называемых центров испарения, и если каким-то образом добиться очистки жидкости, то ее можно нагреть до температур, значительно превышающих температуру кипения при данном внешнем давлении. Такие жидкости называются перегретыми.
Аналогичное утверждение относится и к конденсации: при отсутствии соответствующих центров, пар ненасыщенный можно охладить ниже температуры конденсации. Перегретая жидкость и переохлажденный пар являются примерами так называемых метастабильных состояний.
Внесение малейшей неоднородности в такие среды приводит к моментальному переходу в другое агрегатное состояние, например, если в сосуд с перегретой жидкостью кинуть щепотку соли, то жидкость моментально закипит, т. к. частицы соли станут центрами испарения.