Лабораторная работа №2
Приготовление растворов и дисперсных систем.
ЦЕЛЬ РАБОТЫ: Приготовление растворов и дисперсных систем, которые в дальнейшем могут быть использованы для исследования их свойств.
ОБОРУДОВАНИЕ И МАТЕРИАЛЫ
1. Химические стаканчики ёмкостью 100 мл.
2. Пипетки ёмкостью 1, 2, 5, 10 мл.
3. Бюретка.
4. Мешочек для диализа.
5. Растворы солей.
Приготовление растворов
1.Смешали 300г. раствора с массовой долей растворенного вещества 0,2(20%) и200г. раствора с массовой долей 0,35 (35%). Вычислить массовую долю растворенного вещества в смеси.
 |












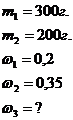


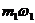 +
+ 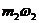 =
= 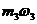
2.Сколько воды и 98% серной кислоты потребуется для приготовления 500г. 25% раствора?
Дано:



















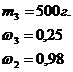
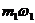 +
+ 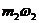 =
= 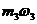
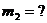 по правилам смешения
по правилам смешения 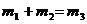 (1)и
(1)и 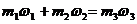 (2),
(2),
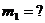 где
где 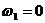 (вода), тогда в уравнении (2)
(вода), тогда в уравнении (2) 
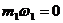 и оно
и оно
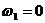 преобразуется в
преобразуется в 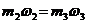 , откуда
, откуда 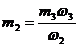 .
.
3.Сколько соли и 20% раствора той же соли потребуется для приготовления 400г. 30% раствора соли?
Дано:















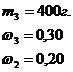
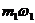 +
+ 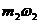 =
= 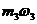
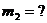 р-р 1(соль) р-р 2р-р 3
р-р 1(соль) р-р 2р-р 3 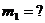 по правилам смешения
по правилам смешения 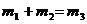 (1)и
(1)и 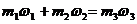 (2),
(2),
где 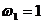 (соль), тогда уравнение (2) преобразуется в
(соль), тогда уравнение (2) преобразуется в 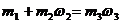 (2).
(2).
4.Определите массу раствора с массовой долей карбоната натрия 0,1 и массу кристаллогидрата Na2CO3 10H2O, которые нужно взять для приготовления раствора массой 540г. с массовой долей Na2CO3 0,15?
 |


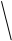


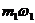 +
+ 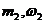 = m3W3
= m3W3



 Дано: Na2СО310Н2О
Дано: Na2СО310Н2О




Дисперсные системы
Физическая конденсация (метод замены растворителя)
ЗОЛЬ СЕРЫ
К 50 мл воды добавляют при взбалтывании 1 мл насыщенного (без нагревания) раствора серы в ацетоне или этиловом спирте. Т. к. сера в воде нерастворима, то при этом образуются мельчайшие ее коллоидные частицы, взвешенные в воде. Наблюдается явление опалесценции.
Химическая конденсация
РЕАКЦИИ ВОССТАНОВЛЕНИЯ. ЗОЛЬ ДИОКСИДА МАРГАНЦА
|
|
5 мл 1,5% раствора KMnO4 разбавляют водой до 50 мл. В разбавленный раствор вводят по каплям 1,5-2 мл 1% раствора Na2S2O3. Образуется вишнево - красный золь диоксида марганца.
РЕАКЦИИ ГИДРОЛИЗА. ЗОЛЬ ГИДРОКСИДА ЖЕЛЕЗА (III)
Реакция получения Fe(OH)3 идет по схеме:
FeCI3 + 3H2O = Fe(OH)3 + 3HCl
Поверхностные молекулы агрегата Fe(OH)3 вступают в реакцию с HCl:
Fe(OH)3 + HCl = FeOCl + 2H2O
Молекулы FeOCl, подвергаясь диссоциации, образуют ионы FeO+ и CI-. Данное обстоятельство необходимо учесть при составлении формулы мицеллы. Для получения золя Fe(OH)3 к 50 мл кипящей воды по каплям добавляют 5-10 мл 2% раствора FeCl3. Золь имеет интенсивный красно – коричневый цвет.
РЕАКЦИИ ДВОЙНОГО ОБМЕНА. ЗОЛИ БЕРЛИНСКОЙ ЛАЗУРИ
а) К 20 мл 0,1% раствора K4[Fe(CN)6] прибавляют при энергичном взбалтывании 5-6 капель 2% раствора FeCl3. Получают золь, окрашенный в темно – синий цвет.
б) К 20 мл 2% FeCl3 прибавляют при энергичном взбалтывании 5-6 капель 0,1% раствора K4[Fe(CN)6]. Получают золь, окрашенный в зеленый цвет.
Чем отличаются полученные золи? Ответ обоснуйте.
Методы диспергирования (пептизация)
ЗОЛЬ БЕРЛИНСКОЙ ЛАЗУРИ. В пробирку к 5 мл 2%-го раствора FeCI3 прибавляют 1 мл насыщенного раствора K4[Fe(CN)6]. Осадок отфильтровывают и промывают дистиллированной водой. При обработке осадка на фильтре 3 мл 0.1н раствора щавелевой кислоты (пептизатор) фильтруется золь берлинской лазури, окрашенный в синий цвет. Анион С2О42- сильно адсорбируется на частицах осадка, сообщая им заряд и агрегативную устойчивость. Напишите формулу мицеллы.
Значение концентрации реагирующих веществ, для получения коллоидных растворов
|
|
В случае низких концентраций весь возможный избыток вещества расходуется на возникновение сравнительно немногочисленных центров кристаллизации, и дальнейший рост частиц тем самым исчерпывается. При средних концентрациях реагирующих веществ получаются грубодисперсные частицы, выпадающие в осадок.
а) В стакан на 100 мл наливают 5 мл 0.005н раствора FeCI3 и добавляют 5 мл 0.005н раствора K4[Fe(CN)6]. Разбавляют полученный раствор 50 мл дистиллированной воды. Получается прозрачный золь берлинской лазури.
б) Выполняют то же, что и в опыте а), беря растворы концентрацией 0.1н. Из мутного раствора выпадает осадок берлинской лазури.
в) В стакан на 100 мл наливают 5 мл насыщенного раствора FeCI3 и 10 мл насыщенного раствора K4[Fe(CN)6]. Образуется студнеобразный осадок. Часть полученного осадка переносят в стакан со 100 мл дистиллированной воды и размешивают. Получается устойчивый золь берлинской лазури.