При выполнении работы необходимо измерить температуру кристаллизации чистого растворителя – воды, раствора неэлектролита и раствора электролита, предложенных преподавателем.
1. Составить таблицу для записи в нее полученных результатов
Растворенное вещество:
А. Неэлектролит_________________
Б. Электролит _________________
| Исследуемый раствор | ТКР | ΔТКР

| МНЕЭЛЕКР | αЭЛ |
| Н2О | ||||
| Раствор неэлектролита-мочевины | ||||
| Раствор электролита KCl |
2. Подготовить криометр к работе, для чего:
● аккуратно извлечь термометр и мешалку из пробирки;
● промыть проточной водой пробирку и сполоснуть ее дистиллированной водой;
●выданный лаборантом лед поколоть на небольшие кусочки;
заложить лед в защитный кожух, поместить в середину льда пробирку и присыпать лед сверху небольшим количеством поваренной соли − хлорида натрия NaCl.
3. Налить в пробирку 10 мл дистиллированной воды, погрузить пробирку в сосуд, наполненный доверху охлаждающей смесью, и закрыть пробкой. В пробирку погрузить термометр и мешалку. Для равномерного охлаждения жидкость медленно помешивать мешалкой и следить по термометру за понижением температуры (не исключено некоторое переохлаждение жидкости).
4. Так как при кристаллизации выделяется скрытая теплота плавления, то небольшое повышение температуры после достижения минимума укажет на окончание процесса кристаллизации. При наблюдении данного эффекта перемешивание прекратить, отметить и записать максимальную температуру подъема (из переохлажденного состояния), которая и будет температурой кристаллизация жидкости.
5. Пробирку извлечь из охлаждающей смеси. Подогревая рукой или теплой водой, растворить кристаллы и вымыть пробирку.
Аналогичные операции повторить для растворов неэлектролита и электролита.
6. На основании полученных результатов рассчитать: а) разность температур кристаллизации растворителя и растворов; б) молекулярную массу растворенного неэлектролита; в) степень диссоциации электролита в растворе.
КОНТРОЛЬНЫЕ ВОПРОСЫИ ЗАДАЧИ
1. Какие факторы влияют на понижение температуры кристаллизации раствора по сравнению с чистым растворителем (закон Рауля)?
2. Каков физический смысл криоскопической и эбулиоскопической констант растворителей?
3. Используя закон Рауля, рассчитайте, при какой температуре будет кипеть сахарный сироп, содержащий 1 моль сахара в 0,5 л
воды (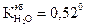 ).
).
4. Определите изотонический коэффициент Вант-Гоффа и степень
диссоциации 1 М раствора Н2S04, замерзающего при -4,6° (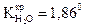 ).
).
Работа № 3. Измерение электропроводности растворов
Цель работы – изучение природы электропроводимости проводников второго рода, установление зависимости удельной и эквивалентной электропроводности от концентрации раствора и определение степени диссоциации слабого электролита.
А. НА ПЕРЕМЕННОМ ТОКЕ
Оборудование
1. Реохордный мост для измерения сопротивления раствора (описание работы на приборе прилагается).
2. Рабочая ячейка с платиновыми электродами (получить у лаборанта).
3. Мерный цилиндр.
4. Кондуктометр «АНИОН 4100».