Углеводороды.
Непредельные (ненасыщенные, алифатические, ациклические, ацетиленовые) углеводороды. Алкины.
Общая формула: CnH2n-2, где n - количество атомов углерода в цепи, больше 2.
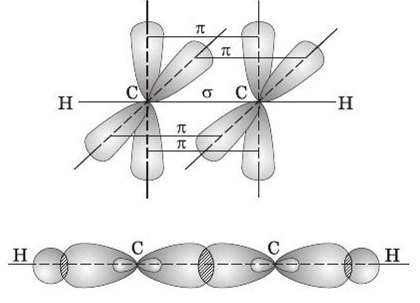
Строение: все атомы углерода в sp – гибридизации, связи ковалентные
σ -связи (сигма-связи) и 2 π -связи (пи-связи), одна тройная связь, молекула линейного строения.
Изомерия:
I. Структурная изомерия:
1) Межклассовая (алкины изомерны соответсвующим алкадиенам, циклоалкенам)

Углеродного скелета (начиная с пентина С5Н8).
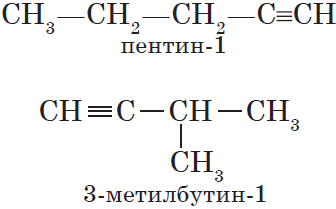
Изомерия положения тройной связи
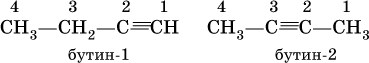
Физические свойства: В нормальных условиях: С2-С4 – газы; С5 –С16 – жидкости; С17 и более – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алканов. Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая.

Тривиальные названия - этин (ацетилен).
Химические свойства
Алкины химически менее активны, чем алкены из-за наличия тройной связи. Для алкинов характерны реакции присоединения, которые могут протекать в две стадии. Повышение полярности концевой связи С-Н вызывает появление очень слабых кислотных свойств.
I. Реакции присоединения 
Гидрогалогенирование
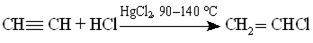 винилхлорид (хлорэтен)
винилхлорид (хлорэтен)
При избытке хлороводоророда идет вторая стадия присоединения:
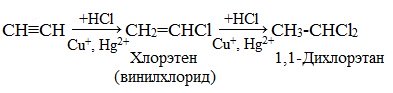
2) Гидратация (+Н2О) - Реакция Кучерова – ЕГЭ!
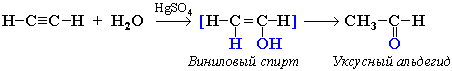
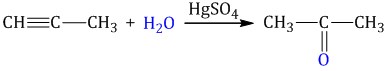
!!! При гидратации ацетилена образуется ацеальдегид (уксусный альдегид), при гидратации других алкинов образуются кетоны.
3) Галогенирование (+Нal) – ЕГЭ!
!*Обесцвечивание раствора брома – качественная реакция на пи-связь.
|
|
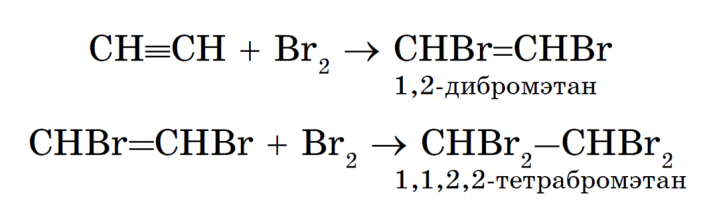
4) Гидрирование (+Н2) – ЕГЭ!
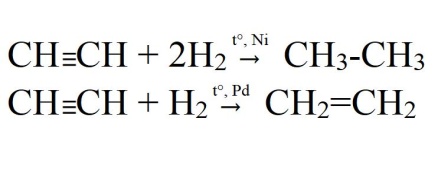
Реакция Полимеризации
Димеризация ацетилена
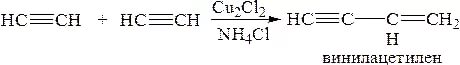
Тримеризация ацетилена (Реакция Зелинского) – ЕГЭ!
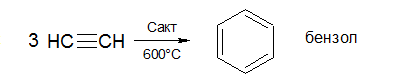
II. Реакция окисления – ЕГЭ!
Мягкое окисление перманганатом калия

Жесткое окисление перманганатом калия
!*Обесцвечивание раствора КМnO4 – качественная реакция на пи-связь.
Условие: кипящий концентрированный раствор перманганата калия (дихромата калия) в кислой среде или нейтральной при нагревании.
Разрывается тройная связь и образуются карбоновые кислоты или СО2 (если связь в конце цепи). Применяют для определения строения по продуктам окисления.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
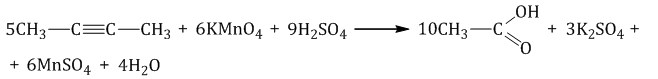
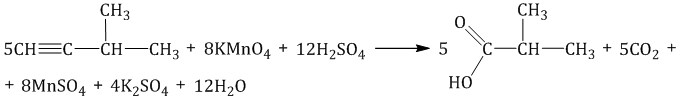
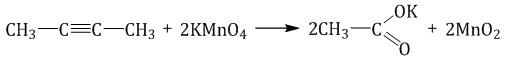 (в нейтральной среде)
(в нейтральной среде)
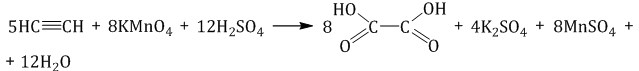
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
Реакция горения (полное окисление)
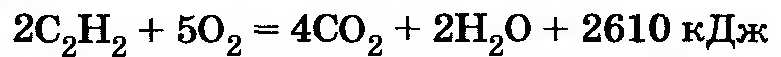
III. Реакции замещения (кислотные свойства алкинов) – ЕГЭ!
! *** Качественная реакция на алкины, в молекулах которых тройная связь находится в конце цепи.
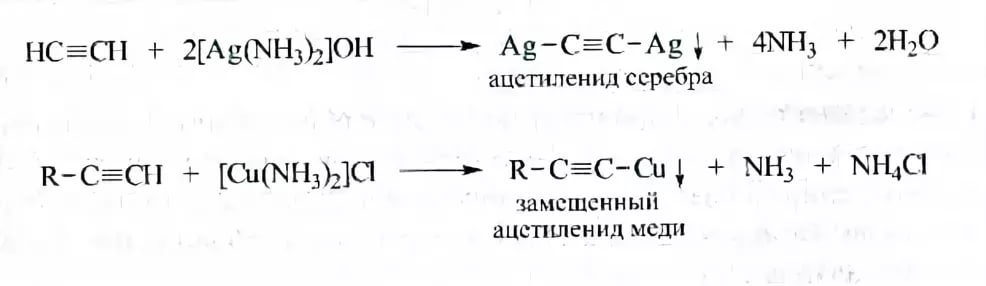
Способы получения:
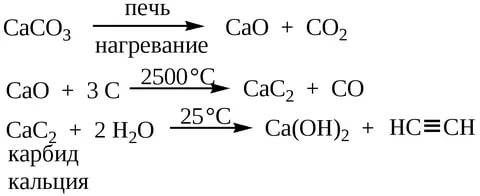
1) Карбидный способ (Лабораторный способ, редко промышленный)

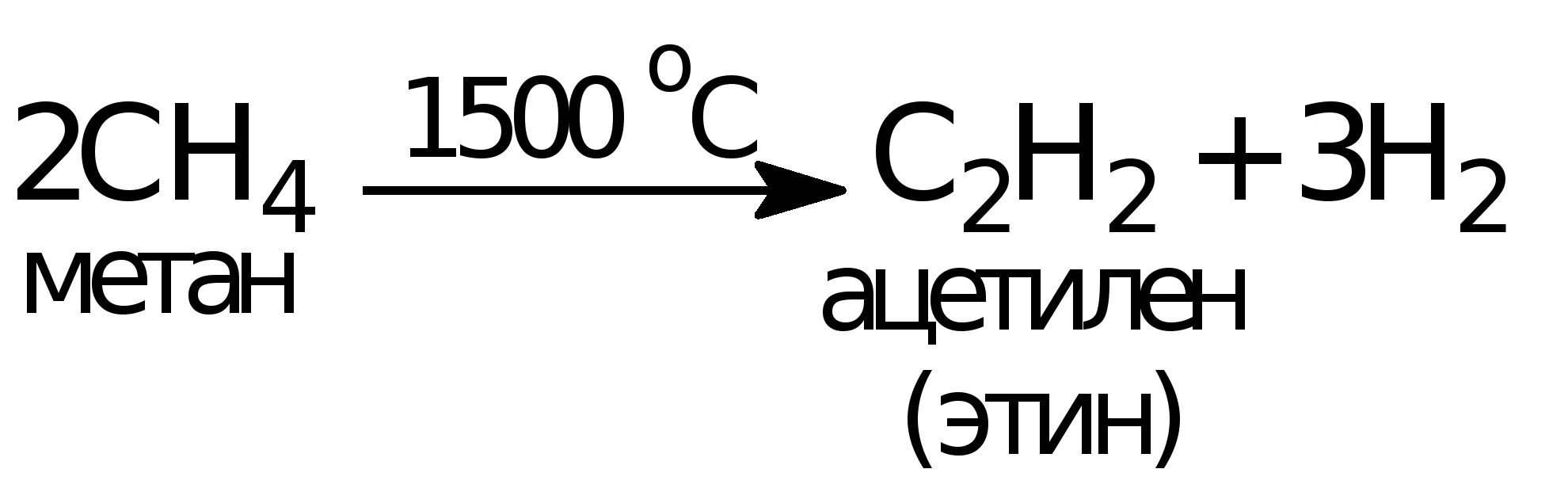
2) Переработка природного газа (промышленный) – пиролиз метана
Дегидрирование этана
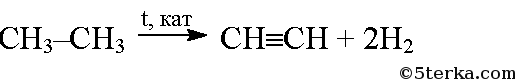
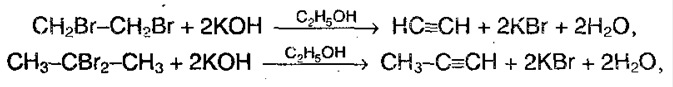
4) Дегидрогалогенирование дигалогеналканов. Лабораторный способ получения ацетилена и его гомологов. Условия: нагревание со спирт. раствором щелочи.
Алкилирование ацетиленидов (удлинение цепи)
|
|
