Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ имени И.М. СЕЧЕНОВА

ОБУЧАЮЩАЯ ЛАБОРАТОРНАЯ ТЕТРАДЬ
ПО КУРСУ ОБЩЕЙ ХИМИИ

СТУДЕНТА_____________________ ГРУППЫ
__________________________ФАКУЛЬТЕТА
__________________________ОТДЕЛЕНИЯ
ФАМИЛИЯ _____________________________
ИМЯ ___________________________________
ОТЧЕСТВО _____________________________
ПРЕПОДАВАТЕЛЬ ______________________
Учебный год
Москва
Занятие 1. Дата ____.____. 20 ___
Тема: Способы выражения состава растворов. Приготовление растворов.
Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая доля растворенного вещества 
Х – растворенное вещество
Молярная концентрация, 
Молярная концентрация эквивалента 
Фактор эквивалентности, 
Молярная масса эквивалента, 
Плотность раствор, 
Моляльная концентрация, 
Задача.
Какой объем соляной кислоты ( ρ =1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
| Дано | Решение |
| V (р-р) =200 мл = 0,2 л С (HCl) = 0,1 моль/л ρ (р-р) = 1,07 г/мл М (HCl) = 36,5 г/моль _____________________ m (р-р HCl) и V (H2O) =? | 1. Объем исходного раствора соляной кислоты можно рассчитать по формуле
 (m (р-р HCl) – неизвестна)
(m (р-р HCl) – неизвестна)
|
2. Массу исходного раствора HCl можно рассчитать по формуле:
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию
n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл
Тема: Способы выражения состава растворов. Приготовление растворов
Решение задач
1. Можно ли использовать для инъекций раствор хлорида натрия, с концентрацией 0,154 моль/л (плотность раствора 1,001 г/л.)?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Рассчитайте молярную концентрацию раствора пероксида водорода с массовой долей вещества равной 3% (плотность раствора пероксида водорода с массовой долей вещества 2% равна 1,0058 г/л, а с массовой долей вещества 4% равна 1,013 г/л.).
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Вычислите, какую массу раствора соли с массовой долей 10% следует взять для приготовления 100 г раствора той же соли с массовой долей, равной 6%.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Смешали по 100 мл растворов KI и КВr с концентрациями 0,1 моль/л. Какова стала концентрация ионов калия и йодид-ионов?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
| ХИМИЧЕСКАЯ ПОСУДА | ||

| 
| 
|
| Мерная колба | Коническая колба | Пробирки |

| 
| 
|
| Бюретка | Химический стакан | Пипетка Мора |

| 
| 
|
| Мерные цилиндры | Воронка | Капельница |

| 
| 
|
| Чашка Петри | Предметные стекла | Стеклянные палочки |

| 
| 
|
| Штатив | Горелка | Штатив Бунзена |
Занятие 2. Дата ____.____. 20 ___
Тема: Количественный анализ.
Теоретический материал к занятию:
Титриметрический анализ – измерение объёма титранта, затраченного на реакцию с анализируемым веществом.
Титрант – раствор с точно известной концентрацией.
Титрование – постепенное добавление титранта к анализируемому веществу до достижения точки эквивалентности.
Точка эквивалентности (т.э.) – момент завершения реакции между титрантом и анализируемым веществом.
Аликвотная проба – точно измеренный объём анализируемого вещества.
Ацидиметрия – титрантом является кислота.
Алкалиметрия – титрантом является основание.
Первичный стандарт – раствор вещества, который готовят по точной массе.
Стандартизация титранта – установление точной концентрации титранта.
Закон эквивалентов: с(1/z X) ∙ V (X) = с(1/z T) ∙ V (T)
Задача 1
Рассчитайте объём 20%-ого раствора KOH (ρ = 1,3 г/мл), необходимый для приготовления 1,5 л раствора с концентрацией С (KOH) = 0,1 моль/л.
| Дано: ω(KOH) = 20% C(KOH) = 0,1 моль/л V(KOH) = 1,5 л ρ = 1,3 г/мл | Эталон решения:
1. Для нахождения объёма раствора KOH с ω = 20% необходимо знать массу раствора и его плотность
V(р-р) = 
|
| V(KOH, 20% р-р) =? | ρ дано в условии задачи, массу раствора следует определить. |
2. Массу раствора щёлочи с ω = 20% можно рассчитать зная массу KOH, содержащуюся в этом растворе:
ω = 
m (р-р) =  ω % дано в условии задачи, массу KOH следует определить.
ω % дано в условии задачи, массу KOH следует определить.
3. Массу KOH можно определить, зная молярную массу KOH и количество вещества KOH.
m(KOH) = M(KOH) ∙ υ(KOH) M(KOH) = 56г/моль.
4. Количество вещества KOH можно определить, зная объём раствора и молярную концентрацию KOH в нём.
υ(KOH) = V(р-р) ∙ C(KOH)
Объём раствора и C(KOH) даны в условии задачи.
1. Находим количество вещества KOH:
n(KOH) = 1,5 л ∙ 0,1 моль/л = 0,15 моль
2. Находим массу щёлочи:
m(KOH) = 0,15 моль ∙ 40 г/моль = 6 г
3. Находим массу исходного раствора, содержащего 6 г KOH:
m(р-р) = 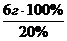 = 30 г
= 30 г
4. Находим объём исходного раствора
V(р-р) =  = 23 мл
= 23 мл
Ответ: Для приготовления требуемого раствора необходимо взять 23 мл исходного раствора. Остальное – вода до объёма 1,5 л.
Задача 2
Раствор гидроксида натрия неизвестной концентрации разбавлен в мерной колбе на 250 мл водой. На титрование 20 мл полученного раствора по реакции:
2NaOH + 2H2SO4 = Na2SO4 + 2H2O
расходуется 24 мл рабочего раствора серной кислоты с C(1/2H2SO4) = 0,08 моль/л.
Определить массу NaOH, содержащуюся в испытуемом растворе.
| Дано: V1(NaOH) = 200 мл = 0,20 л. V2(NaOH) = 20 мл V(H2SO4) = 22 мл С(1/2H2SO4) = 0,055 моль/л | Эталон решения:
1. По закону эквивалентов находим молярную концентрацию эквивалента NaOH.
С(NaOH) ∙V(NaOH) = C(1/2H2SO4) ∙V(H2SO4)
C(NaOH)=  = 0,605 моль/л. = 0,605 моль/л.
|
| m (NaOH) =? |
2. Находим массу NaOH во всём объёме:
m(NaOH) = C(NaOH) ∙V1(NaOH) ∙M(NaOH)
m(NaOH) = 0,605 моль/л∙0,20 л∙40 г/моль = 4,84 г
Ответ: В растворе содержится 4,84 г NaOH.
Домашнее задание:
1. Приведите пример вещества (X), количественное содержание которого в водном растворе можно определить прямым алкалиметрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов. Вычислите массу вещества (X), если на титрование затрачено 20,0 мл раствора титранта (какого?), с(Т) = 0,1 моль/л.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Приведите пример вещества (X), количественное содержание которого в растворе можно определить прямым ацидиметрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов для этой реакции. Вычислите молярную концентрацию вещества (X), если на титрование раствора вещества (X) объемом 15,0 мл было затрачено 12,0 мл титранта (какого?), с (Т) = 0,07 моль/л.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Приведите пример вещества (X), количественное содержание которого в растворе можно определить прямым перманганатометрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов для этой реакции. Вычислите молярную концентрацию вещества (X) если на титрование 5,00мл исследуемого раствора затрачено 12,00 мл раствора титранта (какого?), с(1/z T) = 0,01 моль/л.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Приведите пример вещества (X), количественное содержание которого можно определить обратным перманганатометрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов. Вычислите молярную концентрацию вещества (X), если к аликвотной доле вещества (X) объемом 10,00 мл добавили раствор сульфата железа (II) объемом 20,00 мл с молярной концентрацией 0,05 моль/л, а на титрование было затрачено 10,00 мл титранта (какого?), с (1/z T) = 0,05 моль/л.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа.