KH2О=Ch+Coh
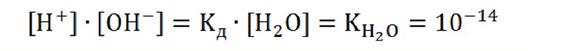
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H+] и [OH—] — переменные, то по их величинам можно говорить о кислотности или щелочности раствора. При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее:
[H+] = [OH—] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
| Нейтральная среда | [H+] = [OH—] = 10-7 М |
| Кислая среда | [H+] > [OH—], [H+] > 10-7 М, [OH—] ˂ 10-7 М |
| Щелочная среда | [H+] ˂ [OH—], [H+] ˂ 10-7 М, [OH—] > 10-7 М |
pH = -lg[H+] = lg (1/[H+])
Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу.
pOH = -lg[OH—] = lg (1/[OH—])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H+] = -lg(1·10-7) = 7
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH

Использование воды: водный транспорт, зоны отдыха, орошение полей, на промышленных предприятиях, ГЭС (гидроэлектростанция), в пищу, в быту, в медицине.
3.
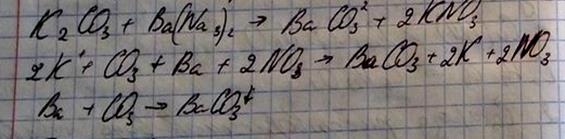
Билет №17.
1. Радиоактивное излучение (или ионизирующее) – это энергия, которая высвобождается атомами в форме частиц или волн электромагнитной природы. Человек подвергается такому воздействию как через природные, так и через антропогенные источники.
Полезные свойства излучения позволили успешно использовать его в промышленности, медицине, научных экспериментах и исследованиях, сельском хозяйстве и других областях.

2. Жиры – сложные эфиры, образованные глицерином и высшими карбоновыми кислотами.
Классификация: Животные и растительные.
Животные жиры (твердые) содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры(жидкие), часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Например, подсолнечное, конопляное и льняное масла. Природные жиры содержат жирные кислоты:
Насыщенные (в составе животных жиров): стеариновая (C17H35COOH); пальмитиновая (C15H31COOH); Масляная (C3H7COOH).
Ненасыщенные (в составе растительных жиров): олеиновая (C17H33COOH, 1 двойная связь); линолевая (C17H31COOH, 2 двойные связи); линоленовая (C17H29COOH, 3 двойные связи); арахидоновая (C19H31COOH, 4 двойные связи, реже встречается).
Свойства: низкая температура плавления и кипения, не имеют запаха, нерасстворяются в воде, расстворяются в органических веществах(например, спирт), гидролиз(могут распадаться,расщепляться в горячей воде)
Роль в живых организмах:
· Энергитическая
· Запасная
· Питательная
3. Дано:
pH=2
Найти: СH+?
Решение: pH=-LgCh+
CH+=10^ph= 10^-2моль/л – кислая среда
Билет №18.
1. При расщеплении тяжелых ядер и при образовании легких ядер высвобождается колоссальное количество энергии
Например при делении 1 г урана 235 выделяется энергия примерно такая как при сгорании 3 тонн каменного угля
Существуют управляемые и неуправляемые цепные ядерные реакции
Управляемые реакции деления происходят в атомном реакторе
Ядерный реактор состоит из ядерного горючего, замедлителя нейтронов, управляющих электродов, теплоносителя и защитного кожуха
В качестве ядерного горючего используют уран235 уран238 и плутоний
Существуют реакторы на медленных нейтронах и быстрых нейтронах В ядерных реакторах на быстрых нейтронах вырабатывается плутоний, который тоже можно использовать в цепных ядерных реакциях
Строительство атомной электростанции дешевле чем строительство гидроэлектростанции, но возникает большая проблема в утилизации продуктов ядерной реакции, которые являются очень радиоактивными
Работа каждой атомной электростанции проверяется и контролируется МАГАТЭ (международное агентство по атомной энергии).
2. Воздух - смесь газов. Туда входит: кислород 21%, углекислый газ до 3%, азот-78%,аргон, гелий, криптон 1%. В выдыхаемом воздухе кислорода на 25% меньше, а углекислого газа - в 100 раз больше.
*Физ.св-ва воздуха: температура, влажность, давление, интенсивность солнечной радиации, ионизирующая радиоактивность.
Химические св-ва воздуха: Азот является разбавителем кислорода, т.к. в чистом кислороде жить невозможно. Кислород может превращаться в азон O3, который является частью атмосферно-азоновый слой, который защищает организмы земли от радиации. Углекислый и угарный газ загрязняет воздух, ухудшает его качество, отравление и летальный исход.
Загрязнение: промышленное, сельское хозяйство, радиоактивное, химическое.
Для соблюдении санитарных норм и правил направленных на предупреждение загрязнении воздуха.
Загрязнение атмосферы - привнесение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение их естественной концентрации.
При решение проблем загрязнений воздуха: озеленение; переносное промышленное предприятие за городскую черту; перевод транспорта на экологический чистый вид топлива; использование альтернативных источников энергии (солнечная батарея); переработка отходов; инстые фильтры.
3. 1.Качественные реакции на моносахариды (глюкоза, фруктоза). Растворяем в воде глюкозу или фруктозу, к раствору глюкозы добавляем гидроксид меди-(голубой гелеобразный осадок), нагреваем смесь, наблюдаем изменение окраски: образуется красный осадок.

2. Сахарозу растворяем в воде, добавляем гидроксид медия и нагреваем. Наблюдаем растворения осадка. Явных изменений не меняется, цвет не изменился.
3. Качественная реакция на поле сахариды. Крахмал растворяем в воде, образуется коллоидный раствор. Добавляем раствор йода. Видим темно-синий раствор. (С6H12O5)n+I2 → синий окрас крахмала.
Билет №19.
1. В организме человека содержится вода(60-70%). Вода необходима для всех обменных процессов в организме. Кроме того,жизненно важным органическим веществам входящим в состав разных органов относит белки,жиры и углеводы(энергия).
Химическим элементам необходимым для жизнидеятельности организма относят элементы.
Биоэлементы:
·Органические
·Неорганические
Делятся на 3 группы:
1.Макроэлементы
2.Микроэлементы
3.Ультрамикроэлементы
Макроэлементы - содержание в организме более одного грамма: фосфор, калий, сера, натрий, хлор, магний, железо, фтор, цинк, кремний, цирконий - 11 элементов.
Микроэлементы - содержание в организме более одного миллиграмма: рубидий, стронций, бром, свинец, ниобий, медь, алюминий, кадмий, барий, бор (первая десятка микроэлементов), ртуть, марганец, йод,золото, хром, и др. - 28 элементов. Каждый элемент влияет на наше здоровье. Содержание элементов в продуктах питания величина очень изменчивая. Более стабильной и постоянной величиной является содержание элементов в организме здорового человека, хотя и оно может иметь вариабельность (изменчивость).
Ультрамикроэлементы - содержание которых в клетке составляет 10%, это серебро, уран, бериллий цезий и др.
Основу живых систем составляют 6 элементов: водород, кислород, углерод, азот, фосфор, сера.
В теле человека находится 10^14 клеток. Железо входит в состав крови.
2. Звук - это упругие продольные волны частотой от 20 Гц до 20000 Гц, вызывающие у человека слуховые ощущения. Источник звука - различные колеблющиеся тела, например туго натянутая струна или тонкая стальная пластина, зажатая с одной стороны.
Скорость распространения звуковых волн в разных средах неодинакова. Она зависит от упругости среды, в которой они распространяются. Медленнее всего звук распространяется в газах. В воздухе скорость распространения звуковых колебаний в среднем равна 330 м/с, однако она может изменяться в зависимости от его влажности, давления и температуры. В безвоздушном пространстве звук не распространяется. В жидкостях звук распространяется быстрее. В твердых телах – еще быстрее (например, стальном рельсе, звук распространяется со скоростью -5000 м/).
При распространении звука в атомы и молекулы колеблются вдоль направления распространения волны, значит звук - продольная волна.
Ультразвук - продольные волны с частотой превышающей 20 000Гц.
Применение:
·Ультразвук используют в промышленности для обнаружения дефектов в изделиях.
·В медицине при помощи ультразвука осуществляют сварку костей, обнаруживают опухоли, осуществляют диагностику заболеваний.
·Биологическое действие ультразвука позволяет использовать его для стерилизации молока, лекарственных веществ, а также медицинских инструментов.
·Совершенные ультразвуковые локаторы имеют летучие мыши и дельфины.
3. Дано:
t=1 час=60 сек
R=100 Oм
I=2А
Найти:
Q-?
Решение: Закон Джоуля Ленца, Q=I^2 умножить на R(сопр) и умнож. на время(t)
Формула: I^2*R*t
4*100*60=24000Дж=24 кДж
Ответ: 24 кДж
Билет №20.
1. Солнечная система – планетная система, включающая в себя центральную звезду — Солнце — и все естественные космические объекты, обращающиеся вокруг Солнца.
В состав Солнечной системы входят: Солнце – центральное тело; девять больших планет с их спутниками (более 60); малые планеты – астероиды (50-60 тысяч); кометы и метеорные тела (метеориты и метеоры).
Вокруг Солнца, движутся восемь больших планет: Меркурий, Венера, Земля, Марс, Юпитер, Сатурн, Уран, Нептун.
Движение планет подчинено закону всемирного тяготения, открытому И.Ньютоном. Согласно этому закону, все тела взаимодействуют между собой с силой, прямо пропорциональной произведению их масс и обратно пропорциональной квадрату расстояния между ними:
m1. m2
F= f ---------, где f –постоянная величина, m1 и m2 – массы двух взаимодействующих тел, r – расстояние между ними.
По своим размерам и физико-химическим свойствам планеты делятся на две группы:
1) планеты «земной» группы (Меркурий, Венера, Земля, Марс) имеют сравнительно небольшие размеры, относительно непродолжительный период обращения вокруг Солнца.
2) планеты-гиганты (Юпитер, Сатурн, Уран, Нептун) имеют гигантские размеры, однотипный химический состав и большое количество спутников. Плутон следует отнести к третьей группе, т.к. по своим размерам он примыкает к планетам «земной» группы.
Кроме больших планет, вокруг Солнца движутся и малые планеты – астероиды. Они образуют самостоятельный пояс между орбитами Марса и Юпитера. Астероиды не имеют определенной формы, а представляют собой угловатые глыбы или обломки.
2. Бионика - это наука о применении в технических устройствах, принципов и свойств живых организмов.
Охрана окружающей среды - это задача экологии.
Экология - это наука о взаимодействии живых организмов с окр. средой.
Охрана окр. среды - это комплекс мер, предназначенных для ограничения отрицательного влияния человека на природу. Такими мерами могут являться ограничение выбросов в атмосферу (промышленность, транспорт): охота, ловли рыбы, с целью сохр. природных ресурсов.
Ограничение выбросов мусора, создания заповедников, и нац.парков.
Деятельность человека - это антропогенная деятельность влияющая на окр. среду.
Право человека благоприятна на окр. среду, закреплено в конституции РФ, в законе об "Охране окр. среды" (от 2002г.) В этом законе указ права и обязанности граждан по охране окр. среды.
3. Реакция нейтрализации – это реакция между кислотой и щелочью.

Билет №21.
1. Твердыми называют такие вещества, которые способны образовывать тела и имеют объем. От жидкостей и газов они отличаются своей формой. Твердые вещества сохраняют форму тела благодаря тому, что их частицы не способны свободно перемещаться. Они отличаются по своей плотности, пластичности, электропроводности и цвету. Также у них есть и другие свойства. Так, например, большинство данных веществ плавятся во время нагревания, приобретая жидкое агрегатное состояние. Некоторые из них при подогреве сразу же превращаются в газ (возгоняются). Но есть еще и те, которые разлагаются на иные вещества.
Виды твердых веществ:
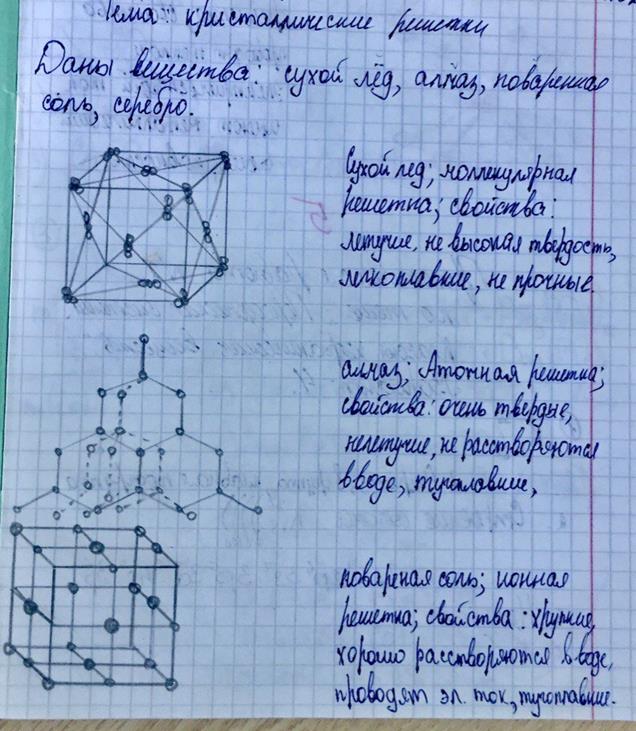
1. Аморфные - бесформенные, вязкие вещества не имеющей кристаллические вещества, сохраняют форму, потому что имеют кристаллическую решетку.
2. Кристаллические - это упорядоченное положение частиц в пространстве, точка в которой находится частица называется узлом кристаллической решетки. Различают 4 типа кристаллической клетки: атомная, молекулярная, ионная, металлическая.
ü Атомная решетка- в узлах которой расположены атомы, соединённые между собой ковалентными связями. (примеры, алмаз, графит, оксид кремния) свойства-очень твёрдые, нелетучесть, не растворяются в воде, тугоплавкие.
ü Молекулярная решетка- в узлах которой расположены молекулы. (примеры, сухой лёд, лёд, кислород, водород, азот, сера, йод, фосфор, сахар, бром) свойства- ионная, не высокая твердость, нелетучесть, легкоплавкие.
ü Ионная решетка- в узлах которой находится заряженный ион. (примеры, все соли, оксиды металлов) свойства- хрупкие, хорошо растворяются в воде, проводит электрический ток, тугоплавкие.
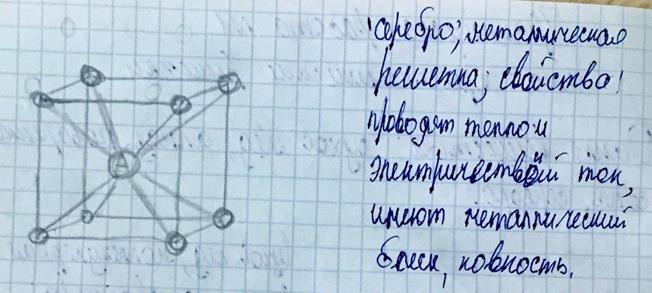
ü Металлическая решетка-в узлах содержит положительно заряженные ионы и нейтральные атомы, между ними передвигаются относительно свободные электроны. Свойства- имеет металлический блеск, ковкие и пластичные, электро и теплопроводность.
2.
ü Доказательством первого положения являются законы постоянных и кратных отношений, а также непосредственное наблюдение этих частиц в электронный микроскоп.
ü Доказательством второго положения являются диффузия и броуновское движение.
Диффузия – это явление самопроизвольного проникновения молекул соприкасающихся веществ в межмолекулярное пространство друг друга. Диффузия происходит и в твёрдых телах, и в жидкостях, и в газах. А значит, молекулы вещества в любом агрегатном состоянии находятся в движении. Чем выше температура, тем больше скорость диффузии.
Примеры диффузии: распространение запаха, смешивание воды и спирта, налитых в один сосуд и т. д.
Броуновское движение – это явление хаотичного движения макроскопических мелких частиц, взвешенных в жидкости или газе, под действием нескомпенсированных ударов молекул жидкости или газа.
Макроскопическими называют тела, состоящие из огромного количества микроскопических частиц (атомов, молекул).
Пример броуновского движения – пылинка в воздухе, совершающая непрерывные и хаотичные движения под действием ударов молекул воздуха.
Можно сказать, что, броуновское движение – это косвенное доказательство движения молекул.
Броун наблюдал в микроскоп движения частиц краски, находящихся в воде, под действием не скомпенсированных ударов молекул воды.
ü Доказательством третьего положения является то, что, несмотря на движение молекул, существуют твёрдые и жидкие тела. Значит, существует сила притяжения молекул. Но между молекулами есть промежутки, т. е. молекулы не «слипаются». Следовательно, кроме сил притяжения есть и силы отталкивания.
Силы упругости при деформации твёрдых тел также являются доказательством существования сил притяжения и отталкивания между молекулами (между центрами молекул)
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0): (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
3. Период колебаний Т = время/кол-во колебаний = 10/40 = 0,4 секунды
Частота = кол-во колебаний/ время = 40/10 = 4 герц
Билет №22.
1. К органическим веществам относят вещ-ва содержащие углерод. Органических вещ-во насчитывется приблизительно 25млн. Такое кол-во возможно благодаря способности углерода обрезать цепочки.
Неорганические вещества - это вещ-ва состоящие из разных элементов, их насчитывают приблизительно 50тыс.
Неорганические вещества делятся на:
· Простые (это вещества состоящие из 1 атома) К ним относят: металлы и неметаллы.
· Сложные (состоят из 2 и более видов атомав) К ним относят: оксиды,соли,основания и кислоты.
Органические вещ-ва: углеводороды, спирты, альдегиды,эфиры,кислоты (лимон,уксус), белки, жиры, углеводы и др. Органические вещ-ва являются материалом для живой природы(животные,человек,растения).
Неорганические вещ-ва являются материалом для неживой природы.
Большинство органических вещ-в горят на воздухе, а неорганических вещ-в не горят на воздухе.
Несмотря на различие, существует связь между органическими и неорганическими вещ-ми. Например, в резульате горения органич. вещ-в образуются неорган.:углекислый газ(CO2), вода(H2O).
2. Тепловое движение: Опытные данные, лежащие в основе молекулярно-кинетической теории, служат наглядным доказательством молекулярного движения и зависимости этого движения от температуры. В отличие от механического движения нагревание или охлаждение тел может привести к изменению их физических свойств. Так, при сильном охлаждении вода превращается в лёд, а нагревание металла до высоких температур вызывает превращение его не только в жидкость, но и в газ. Течение тепловых процессов непосредственно связано со структурой вещества, поэтому тепловые явления могут быть использованы для объяснения строения вещества, а строение вещества, в свою очередь, даёт нам представление о физической сущности тепловых явлений.
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт явился одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.

где s — смещение полосы, l — расстояние между цилиндрами, а u — скорость движения точек внешнего цилиндра.
Абсолютная температура как мера средней кинетической энергии частиц: ‹E› = kT, Где k = 1,38∙10-23 Дж/К – постоянная Больцмана [T] = 1K = 10C Постоянная Больцмана является коэффициентом, переводящим температуру из градусной меры в энергетическую и обратно. Кинетическая энергия не может быть отрицательной. Следовательно не может быть отрицательной и термодинамическая температура. Единица температуры по шкале Кельвина (один Кельвин, К) равна одному градусу Цельсия: 1 К = 1 0С
3. H=gt^2/2
g=2h/t^2=160/100=1,6м/с^2
Билет №23.
1. Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков. Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д. Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Классификация:
·Кислые (в которых один или несколько атомов водорода, не были замещены на атом металла; например: гидросульфаты, дигидро-, и гидрофосфаты и пр.);
· Средние (в которых все атомы водорода замещены на атомы металла; например хлориды, нитраты, сульфаты, силикаты и т.д.);
· Основные (это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками; например: ZnOHCl, (CuOH)2CO3);
Свойства:
1) Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑
2) Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2
3) Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3
4) Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓
Применение: военная промышленность, химическая промушленность, пищевая промышленность, в быту, медицина, строительство, сельское хоз-во.
2. В зависимости от условий одно и то же вещество может находиться в различных состояниях: в твёрдом, жидком или газообразном (например, вода, лёд, водяной пар). Эти состояния называются агрегатными.
Молекулы одного и того же вещества в твёрдом, жидком или газообразном состоянии одни и те же, ничем не отличаются друг от друга, меняется их взаимное расположение.
В газах расстояние между атомами и молекулами в среднем во много раз больше размеров самих молекул. Молекулы с огромными скоростями движутся в пространстве.
Молекулы жидкости расположены почти вплотную друг к другу. Они колеблются около положений равновесия, сталкиваясь с соседними молекулами. Иногда молекулы совершают перескоки с места на место.
У твёрдых тел атомы и молекулы занимают строго упорядоченные положения в пространстве, образуя кристаллическую решётку.
Переход вещества из одного состояния в другое называют фазовым переходом.
Изменение внутренней энергии может приводить к изменению агрегатного состояния. При нагревании молекулы начинают больше колебаться и двигаться, и расстояние между ними увеличивается. Переход вещества при определённой температуре из твёрдого состояния в жидкое называется плавлением. Переход вещества из жидкого состояния в твёрдое называется отвердеванием или кристаллизацией. Переход вещества из жидкого состояния в газообразное называется испарением. Переход вещества из газообразного состояния в жидкое называется конденсацией.
3. R = R1R2/R1+R2 = 75*300/75+300 = 60 Ом
Билет №24.
1. Оксиды - это сложные вещества состоящие из двух химических элементов, один из которых O2^-2 (CO2,H2SO4,CuO)
Оксиды делятся: основные и кислотные
Основные(маталлы +1;+2;+3) K2O;СaO;MgO;Cuo
Кислотные (нематаллы +4;+5;+6) Co2;SO2;P2O5
1) Кислотные оксиды взаимодеуйствуют с остальными:
·CaO+Co2→CaCo3
2) Взаимодействуют с водой:
·Na2O+H2O→2NaOH основание
·СO2+H2O→H2CO3 угольная кислота
3) Основные оксиды реагируют с кислотами солью и водой:
·CaO+H2SO4→CaSO4+H2O
4) Кислотные оксиды взаимодействуют с основаниями:
·CO2+2KOH→K2CO3+H2O
2. Тепловой двигатель – устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
К тепловым двигателям относятся: паровая машина, двигатель внутреннего сгорания, паровая и газовая турбины, реактивный двигатель. Их топливом является твердое и жидкое топливо, солнечная и атомная энергии.
Виды: паровая машина, ДВС(двигатель внутреннего сгорания), газовая и паровая турбина, реактивный двигатель.
Применение: Наибольшее значение имеет использование тепловых двигателей (в основном мощных паровых турбин) на тепловых электростанциях, где они приводят в движение роторы генераторов электрического тока. Около 80% всей электроэнергии в нашей стране вырабатывается на тепловых электростанциях.
Тепловые двигатели (паровые турбины) устанавливают также на атомных электростанциях. На этих станциях для получения пара высокой температуры используется энергия атомных ядер. На всех основных видах современного транспорта преимущественно используются тепловые двигатели.
На автомобилях применяют поршневые двигатели внутреннего сгорания с внешним образованием горючей смеси (карбюраторные двигатели) и двигатели с образованием горючей смеси непосредственно внутри цилиндров (дизели). Эти же двигатели устанавливаются на тракторах.
Без тепловых двигателей современная цивилизация немыслима. Мы не имели бы дешевую электроэнергию и были бы лишены всех видов современного скоростного транспорта.
Отрицательное влияние:
1. Использование кислорода из атмосферного воздуха.
2. Выделением в атмосферу при сжигании углекислого газа.
3. При сжигании угля и нефти атмосфера загрязняется азотными и серными соединениями.
4. Более половины всех загрязнений атмосферы создает транспорт ежегодно выбрасывая в атмосферу 2-3 млн. тонн свинца
Варианты уменьшения негативного влияния:

3. Водяной пар отличается от воды агрегатным состоянием. У воды есть 3 агрегатных состояния - твердое (лед), жидкое (вода обычная) и газообразное (водяной пар).
У водяного пара, естественно, расстояние между молекулами больше.
Билет №25.
1. Щелочи -гидроксиды щелочных, щелочноземельных металлов и некоторых других элементов(Tl). к щелочам относят хорошо растворимые в воде основания. При диссоциации щелочи образуют анионы OH− и катион металла.
Классификация: Растворимые в воде (NaOH,Сa(OH)2)
Нерастворимые в воде (Cu(OH)2, Mg(OH)2)
Свойства: щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду.Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Применение щелочей:
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
2. Электрический заряд – это физическая величина, которая определяет интенсивность электромагнитных взаимодействий.
Электрические заряды делятся на положительные и отрицательные. Положительным зарядом обладают стабильные элементарные частицы – протоны и позитроны, а также ионы атомов металлов и т.д. Стабильными носителями отрицательного заряда являются электрон и антипротон.
Силы взаимодействия неподвижных зарядов прямо пропорциональны произведению модулей зарядов и обратно пропорциональны квадрату расстояния между ними:

Силы взаимодействия подчиняются третьему закону Ньютона: 
Они являются силами отталкивания при одинаковых знаках зарядов и силами притяжения при разных знаках. Взаимодействие неподвижных электрических зарядов называют электростатическим или кулоновским взаимодействием.
3.

Билет №26.
1. Фотоэлектрическим эффектом (фотоэффектом) называют группу явлений, возникающих при взаимодействии света с веществом и заключающихся либо в эмиссии электронов (внешний фотоэффект), либо в изменении электропроводимости вещества или возникновении электродвижущей силы (внутренний фотоэффект).
Выделяют три основных вида фотоэффектов: внутренний, внешний и вентильный.
Внутренним фотоэффектом называется перераспределение электронов по энергетическим состояниям в твёрдых и жидких полупроводниках и диэлектриках, происходящее под действием излучений. Он проявляется в изменении концентрации носителей зарядов в среде и приводит к возникновению фотопроводимости или вентильного фотоэффекта.
Внешним фотоэффектом называется испускание электронов веществом под действием электромагнитных излучений. Электроны, вылетающие из вещества при внешнем фотоэффекте, называются фотоэлектронами, а электрический ток, образуемый ими при упорядоченном движении во внешнем электрическом поле, называется фототоком.
Вентильный фотоэффект является разновидностью внутреннего фотоэффекта, – это возникновение ЭДС (фото ЭДС) при освещении контакта двух разных полупроводников или полупроводника и металла (при отсутствии внешнего электрического поля). Вентильный фотоэффект открывает пути для прямого преобразования солнечной энергии в электрическую.
Применение: кино (воспроизведение звука), фототелеграф, фотометрия(для измерения силы света, якости, освещенности), управление производственными процессами.
2. Пищевые добавки - это природные и хим.вещ-ва, которые специально вносят в пищевые продукты для решения технологических задач.
Пищевые добавки делятся:
1.Природные добавки (перец)
2.Синтетические добавки
3.Пищевые добавки, полученные искуственным путем. Екод
Пищевые добавки делятся на группы:
1.Красители Е100-Е199 (для изменения или поддержания цвета)
2.Консерванты Е200-Е299 (это вещ-ва продливающие срок хранения продукта,защищает от порчи)
3.Антиокислители Е300-Е399 (защищает микробов от прогорания, от изменения цвета, от окисления эмугальтора
4.Стабилизаторы Е400-Е499(образуют однородные, поддерживают консистенцию, предупреждают расслоение)
5.Регуляторы кислотности, разрыхрытели Е500-Е599 (предают кислый вкус, предотвращают высыхание)
6.Усилители аромата Е600-699
7.Запасные индекса Е700-Е800
8.Улучшители хлеба Е900 и более. Природные добавки безопасные, но дорогие.
9.Искусственные добавки не безопасны, но достаточно дешевые.
Роль:
ü Совершенствование технологии подготовки и переработки пищевого сырья, применяемые при этом добавки не должны маскировать последствий использования некачественного или испорченного сырья
ü Сохранение природных качеств пищевого продукта
ü Улучшение органолептических свойств или структуры пищевых продуктов и увеличение их стабильности при хранении
ü Применение пищевых добавок допустимо только в том случае, если они даже при длительном потреблении в составе продукта не угрожают здоровью человека
3. Na2CO3+2HCL = 2NACL+H2O + CO2
2Na+ + CO3 2- + 2H+ + 2CL- = 2Na+ + CL- + H2O + CO2
CO3 2- + 2H+ = H2O + CO2
Билет №27.
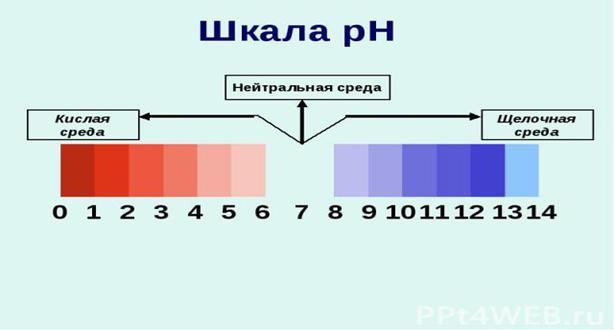
1. Водородный показатель (шкала рН) - это концентрация ионов водорода в растворе.
Значение рН необходимо знать для определения хар-ра среды. Значение рН могут быть от 0 до 14. рН=-LgCh+
·Пищевые вещества должны содержать белки, жиры, углеводы, минеральные вещества, витамины и биологические активные компоненты, которые должны находится в определенном соотношении 1:1:4 (б:ж:угл.)
·Соблюдение режима питания 5-6 раз в день с промежутками 3-4 часа.
·Оптимальное условия для усвоения пищи.
Пищеварительная система - это совокупность процессов обеспечивающие физические и химические расцепление пищевых веществ на простые вещества способных всасываться в кровь и участвующих в жизненно важных функциях организма.
Физические изменения пищи заключаются в её механической обработке: размельчении, перемешивании, набухании и растворении.
Химические изменения пищи состоят в последовательном расщеплении белков, жиров и углеводов при действии на них секретов пищеварительных желёз. Важнейшим компонентом пищеварительных соков (слюна, желудочный, поджелудочный и кишечный сок) являются гидролазы – ферменты, катализирующие расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
Пищеварительная система состоит:
·Ротовая полость
·Слюнные железы
·Глотка
·Пищевод
·Желудок
·Двенадцатиперстная кишка
·Печень
·Желочный пузырь
·Щелочный проток
·Поджелудочная железа
·Тонкая кишка
·Толстая кишка
·Прямая кишка
Для профилактики пищеварительных систем необходимо соблюдать режим питания, кулинарную обработку пищи. Условия приема пищи. Необходимо правильно распределять суточный объем пищи.
2. Электрическое поле – отдельная форма проявления (наряду с магнитным полем) электромагнитного поля.
Силовые линии - это такие линии, которые проведены в любом силовом поле (электрическом, магнитном или гравитационном), касательные к которым в каждой точке пространства совпадают с направлением вектора, который характеризует данное поле (в э.п. это вектор напряжённости, в магнитном - вектор магнитной индукции).
Свойства силовой линии:
1.Силовые линии электрического поля имеют начало и конец. Они начинаются на положительных зарядах и заканчиваются на отрицательных.
2.Силовые линии электрического поля всегда перпендикулярны поверхности проводника.
3.Распределение силовых линий электрического поля определяет характер поля.
4. Поле может быть, р адиальным (если силовые линии выходят из одной точки или сходятся в одной точке), однородным (если силовые линии параллельны) и неоднородным (если силовые линии не параллельны).

3.
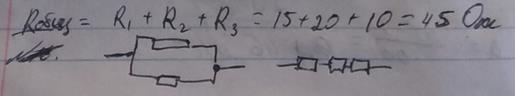
Билет №28.
1. Организм человека состоит из клеток. Ткань - совокупность клеток, имеющих общее происхождение, сходное строение и выполняющих одинаковые функции.
Различают 4 основных типа тканей:
·Эпитеальная (коженая)
·Соединительная ткань
·Мышечная ткань
·Нервная ткань
Ткани образуют органы, которые имеющие определенную форму, строение, распололжение и выполняющие определенные функции.
Система органов - это группа органов выполняющих определенную фун-цию.
В организме человека различают следующие системы органов:
1.Опорно-двигательная (скелет)
2.Нервная система
3.Эндокринная система (щитовидная железа)
4.Сердечно-сосудистая
5.Дыхательная
6.Пищеварительная
7.Выделительная
8.Половая
2. Диэлектрики - это такие тела, которые не могут проводить электрический ток от заряженного тела к заряженному, имеют связанные заряды.
Электрическое поле -это особый вид материи, с помощью которого осуществляется взаимодействие между заряженными телами.
При изменении внешних условий (нагревание, воздействие ионизирующих излучений и т. п.) диэлектрик может проводитьэлектрический ток. Изменение состояния диэлектрика при помещении в электрическое поле можно объяснить его молекулярнымстроением. Условно выделим три класса диэлектриков: 1) полярные; 2) неполярные; 3) кристаллические.
I.К первому классу принадлежат такие вещества, как вода, нитробензол и др. Молекулы этих диэлектриков не си