В газах коэффициент теплопроводности может быть найден по приближённой формуле[2]

где 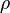 — плотность газа,
— плотность газа, 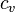 — удельная теплоёмкость при постоянном объёме,
— удельная теплоёмкость при постоянном объёме, 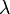 — средняя длина свободного пробега молекул газа,
— средняя длина свободного пробега молекул газа, 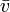 — средняя тепловая скорость. Эта же формула может быть записана как
— средняя тепловая скорость. Эта же формула может быть записана как
42, связь между коэффициентами переноса - Если сравнить выражения коэффициентов диффузии и вязкости, то легко установить, что они между собой связаны таким соотношением:

43, Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды.
44, Неравновесная термодинамика — раздел термодинамики, изучающий системы вне состояния термодинамического равновесия и необратимые процессы. Релаксация (от лат. relaxatio — ослабление, уменьшение) — процесс установления термодинамического, а следовательно, и статистического равновесия в физической системе, состоящей из большого числа частиц.
45, К вопросу о Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия. Такие процессы называют также квазиравновесными, так как систему в каждый момент времени можно считать находящейся в состоянии термодинамического равновесия[1].
46, Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема
47. Аксиоматика термодинамики имеет своей задачей выявление структуры термодинамических понятий и законов[1] с целью логически непротиворечивого введения в научный оборот макроскопических физических величин, которым не даётся определения в других разделах физики, — внутренней энергии, энтропии и температуры
48, Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло.
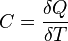
49, В случае простой термодинамической системы (простого тела) термодинамической работой называется работа сжимаемого тела в зависимости от абсолютного давления  и изменения объёма
и изменения объёма 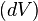 :
:
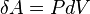
или в интегральной форме:

50, Количество переданной энергии системе внешними телами путем теплообмена, называют теплотой (количеством теплоты).
51, 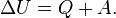
52, При изобарном нагревании газ совершает работу над внешними силами  , где
, где  и
и 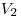 — начальный и конечный объемы газа.
— начальный и конечный объемы газа.
53, Работа положительна, если направление силы и перемещения совпадают и отрицательна, если они противоположны. Из этого следует, что при сжатии газа положительна работа внешних сил, а при расширении положительную работу совершает газ.
54, Молярная теплоёмкость — теплоёмкость 1 моля идеального газа.


Полезно знать формулу Майера для удельных теплоёмкостей:
 .или .или
|
55, Первое начало термодинамики:
В любой изолированной системе запас энергии остаётся постоянным.
Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
| Q = ΔU + A. |
56,
|
|
|
|
|
|
|
|
57, 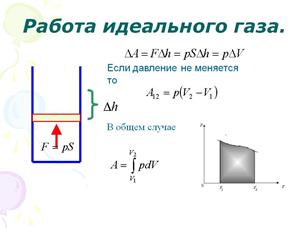
58, Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
59, Запишем первое начало термодинамики для различных изопроцессов и адиабатического.
Начнём рассмотрение с изобарного процесса.
1) P=const; m=const.
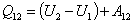
| (53.1) |
- интегральная запись первого начала термодинамики для изобарного процесса.
В изобарном процессе всё полученное системой количество теплоты идёт на приращение внутренней энергии и совершение работы против внешних сил.
Но для него также выполняется закон Гей-Люссака:
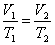
|
2) Рассмотрим изохорный процесс.
V=const; m=const; A12=0; dA=0.
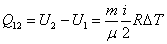
| (53.12) |
– интегральная форма записи первого начала термодинамики для изохорного процесса.

| (53.13) |
– дифференциальная форма записи первого начала термодинамики для изохорного процесса.
Таким образом, в изохорном процессе всё полученное системой количество теплоты идёт на приращение внутренней энергии.
3) Рассмотрим изотермический процесс:
Т=const; m=const; ΔU=0, A12≠0

| (53.14) |
- интегральная запись первого начала термодинамики для изотермического процесса.
В изотермическом процессе всё полученное системой количество теплоты идёт на совершение работы против внешних сил.
4) Адиабатный процесс.
По определению - адиабатный процесс происходит без теплообмена с окружающей средой: Q12=0, тогда интегральная форма записи первого начала термодинамики для адиабатного процесса имеет вид:
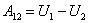
|
60, Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении (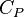 ) к теплоёмкости при постоянном объёме (
) к теплоёмкости при постоянном объёме (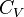 ). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой
). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой 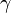 (гамма) или
(гамма) или  (каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква
(каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква 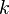 [1].
[1].
Уравнение:
 ,
,
где
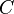 — теплоёмкость газа,
— теплоёмкость газа,
 — удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
— удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
61, Вечный двигатель первого рода — устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Согласно закону сохранения энергии, все попытки создать такой двигатель обречены на провал. Невозможность осуществления вечного двигателя первого рода постулируется в термодинамике как первое начало термодинамики.
62, Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
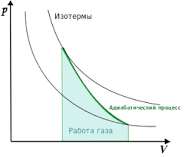
Политро́пный процесс, политропи́ческий процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
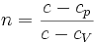
63, уравнение Пуассона - Это уравнение имеет вид: 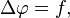
где 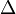 — оператор Лапласа, или лапласиан, а
— оператор Лапласа, или лапласиан, а 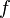 — вещественная или комплексная функция на некотором многообразии.
— вещественная или комплексная функция на некотором многообразии.
64, Для идеального газа справедливо соотношение Майера:
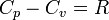
^ к вопросу о Уравнении Майера.
65, Холодильные машины и установки предназначены для искусственного снижения и поддержания пониженной температуры ниже температуры окружающей среды от 10 °С и до −153 °С в заданном охлаждаемом объекте. Машины и установки для создания более низких температур называются криогенными.
66, Направленность термодинамическмих процессов - Следовательно, в изолированной системе самопроизвольно протекают процессы в направлении большего беспорядка или наиболее вероятного существования.
67,Цикл Карно в различных координатах
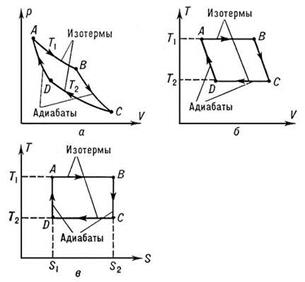
68, Для ts координат. 1. Изотермическое расширение (на рис. 1 — процесс A→Б). В начале процесса рабочее тело имеет температуру 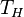 , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты
, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты 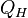 . При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника 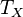 , тело совершает механическую работу, а энтропия остаётся постоянной.
, тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 — процесс В→Г). Рабочее тело, имеющее температуру 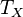 , приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты
, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты  . Над телом совершается работа, его энтропия уменьшается.
. Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
69, Для реальных тепловых двигателей коэффициент полезного действия равен из-за разного рода энергетических потерь приблизительно равен 40%,
Коэффициент полезного действия идеальной тепловой машины:

Эта формула дает теоретический предел для максимального значения коэффициента полезного действия тепловых двигателей. Она показывает, что тепловой двигатель тем эффективнее, чем выше температура нагревателя и ниже температура холодильника. Лишь при температуре холодильника, равной абсолютному нулю, КПД будет равен 1.
70, Второе начало термодинамики – теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому.
71, Отношение Q / T называется приведенным количеством теплоты.
72, Теорема Карно
1. Коэффициент полезного действия любой обратимой тепловой машины, работающей по циклу Карно, не зависит от природы рабочего тела и устройства машины, а является функцией только температуры нагревателя и холодильника: 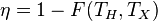
2. Коэффициент полезного действия любой тепловой машины, работающей по необратимому циклу, меньше коэффициента полезного действия машины с обратимым циклом Карно, при условии равенства температур их нагревателей и холодильников: 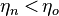 »
»
Другие авторы (например, Б. М. Яворский и Ю. А. Селезнев) указывают на три аспекта одной теоремы Карно, цитата (см. стр. 151—152.):
«3°. Термический к.п.д. обратимого цикла Карно не зависит от природы рабочего тела и определяется только температурами нагревателя 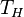 и холодильника
и холодильника 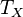 :
:
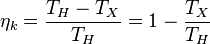
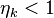 , ибо практически невозможно осуществить условие
, ибо практически невозможно осуществить условие 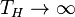 и теоретически невозможно осуществить холодильник, у которого:
и теоретически невозможно осуществить холодильник, у которого:  .
.
4°. Термический к.п.д. 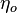 произвольного обратимого цикла не может превышать термический к.п.д. обратимого цикла Карно, осуществленного между теми же температурами
произвольного обратимого цикла не может превышать термический к.п.д. обратимого цикла Карно, осуществленного между теми же температурами 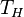 и
и 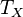 нагревателя и холодильника:
нагревателя и холодильника:
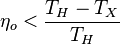 .
.
5°. Термический к.п.д. 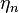 произвольного необратимого цикла всегда меньше термического к.п.д. обратимого цикла Карно, проведенного между температурами
произвольного необратимого цикла всегда меньше термического к.п.д. обратимого цикла Карно, проведенного между температурами 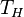 и
и 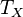 :
:
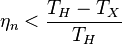 .
.
Пункты 3° — 5° составляют содержание теоремы Карно.»
73, Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
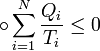
74, Энтропи́я функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии.
75, Энтропия как функция состояния системы, связана со статистическим весом формулой: S=k*ln*W
76. Для определения абсолюного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s0=0 при Т0 и Р0, воспользовавшись уравнением (4.60), получим
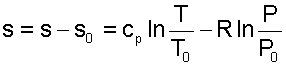
|
77, Третье начало термодинамики (теорема Нернста) — Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система
78, Связь энтропии и термодинамической вероятности состояния логарифмическая:
S = k*ln(W) -> W = e^(S/k).
Это понятно из следующих рассуждений: энтропия пропорциональна массе -> суммарная энтропия системы состоит из суммы энтропий составных системы -> вероятность состояния всей системы равна произведению вероятности состояния отдельных частей -> суммированию энтропий соответствует умножение вероятностей -> логарифмическая связь энтропии системы и термодинамической вероятности состояния системы.
79, В 1877 году Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
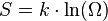
где константа 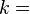 1,38·10−23 Дж/К названа Планком постоянной Больцмана, а
1,38·10−23 Дж/К названа Планком постоянной Больцмана, а 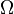 — статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние.
— статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние.
80, Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона: 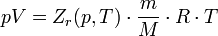
где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.
81, Потенциал Леннард-Джонса записывается в следующем виде:
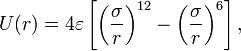
где  — расстояние между центрами частиц,
— расстояние между центрами частиц,  — глубина потенциальной ямы,
— глубина потенциальной ямы,  — расстояние, на котором энергия взаимодействия становится равной нулю. Параметры
— расстояние, на котором энергия взаимодействия становится равной нулю. Параметры  и
и  являются характеристиками атомов соответствующего вещества. Характерный вид потенциала показан на рисунке, его минимум лежит в точке
являются характеристиками атомов соответствующего вещества. Характерный вид потенциала показан на рисунке, его минимум лежит в точке  .
.
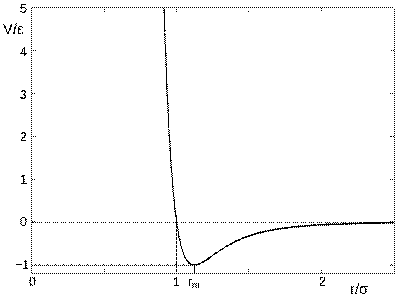
| 82, Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса. |
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
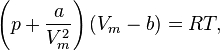 где
где
|
83, Эффе́ктом Джо́уля — То́мсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
84, Изменение энергии газа в ходе этого процесса будет равно работе: 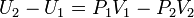 . Следовательно, из определения энтальпии (
. Следовательно, из определения энтальпии (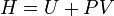 ) следует, что процесс изоэнтальпиен.
) следует, что процесс изоэнтальпиен.
85, Критическая температура фазового перехода — значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
86, Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической точке, т.е. в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдем эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:
Мы получили уравнение третьей степени относительно 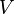 .
.
87, Метастабильное состояние
— состояние квазиустойчивого равновесия физической системы, в котором система может находиться длительное время.
Что такое метастабильное состояние, может быть понятно из приведенного справа рисунка:
- состояние 1: метастабильное — состояние, стабильность которого сохраняется при не очень больших возмущениях;
- состояние 2: нестабильное — состояние, стабильность которого нарушается при сколь угодно малых возмущениях;
- состояние 3: стабильное — состояние, стабильность которого сохраняется при больших возмущениях.
88, внутренняя энергия реального газа представляет собой однозначную функцию его состояния, т.е. однозначную функцию любых двух независимых параметров, определяющих это состояние, поэтому сама может служить параметром состояния.
89, Наиболее распространённые примеры фазовых переходов первого рода:
- плавление и кристаллизация
- испарение и конденсация
- сублимация и десублимация
· Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
· Типы фазовых равновесий:
· Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
· Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
· Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
90, При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
91, Тройна́я то́чка в однокомпонентной системе — точка схождения кривых двухфазных равновесий на плоской P—T-фазовой диаграмме, соответствующая устойчивому равновесию трёх фаз. Тройная точка нонвариантна, т. е. не допускает изменения ни одного из характеризующих её параметров состояния — ни температуры, ни давления.
92, Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки).
93, Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением
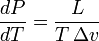
где  — удельная теплота фазового перехода,
— удельная теплота фазового перехода, 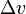 — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.
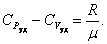
 — давление,
— давление,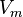 — молярный объём,
— молярный объём,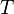 — абсолютная температура,
— абсолютная температура,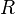 — универсальная газовая постоянная.
— универсальная газовая постоянная.