Электрохимические процессы и явления
| Выполнил(а): Студент(ка) 1-го курса Группы №__________________ ФИО ______________________ ___________________________ ___________________________ | Проверил: Молочко А.П. |
Минск 2016
Экспериментальная часть
1. Установить химическую активность металлов в водных растворах
электролитов и их положение в электрохимическом ряду активностей
Ход опыта и результаты наблюдений опыта.
Для выполнения эксперимента использовались металлы и растворы солей, представленные в табл.1.Так как исследуемые реакции являются окислительно-восстановительными и условием их протекания является неравенство  , выписали из табл.П.3 пособия значения φ0 для следующих сопряженных пар:
, выписали из табл.П.3 пособия значения φ0 для следующих сопряженных пар:


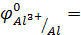
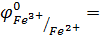
φ0 Fe3+/Fe =
Величина φ0 металла указывает на меру восстановительной способности
атомов металлов и меру окислительной способности их ионов и, чем больше ее значение, тем ярче выражена окислительная способность. Из двух возможных реакций наиболее предпочтительна та, для которой неравенство φо к > φ восст. выполняется в большей степени. Результаты теоретического прогноза омечены в табл.1.
Таблица 1.
| Металлы | CuSO4 | ZnSO4 | Al2(SO4)3 | FeCl3 (индикатор K3[Fe(CN)6]) |
| Zn | ||||
| Cu | ||||
| Al |
Примечание: В ходе эксперимента проводить только те взаимодействия, которые возможны в соответствии с установленным условием их протекания.
1.2. При анализе результатов опыта ответить на вопросы:
1. Объяснить появление синего окрашивания растворов в пробирках с FeCl3 и K3[Fe(CN)6], а также отсутствие признаков реакций Al с растворами солей CuSO4 и ZnSO4
2. Составить уравнение реакции ионов Fe2+ c индикатором K3[Fe(CN)6] и образованием турнбулевой сини Fe3[Fe(CN)6]2, а также уравнения всех реакций в молекулярной и краткой ионной формах.
2. Какой из исследованных металлов самый активный и какой наименее? Расположите исследуемые металлы по убыванию их активности в водных растворах.
3. Укажите влияние пассивирующих (оксидных) слоев на поверхности активных металлов на характер протекания окислительно-восстановительных реакций.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Определение стандартной ЭДС химического гальванического элемента
Ход и данные опыта
Для выполнения данного опыта собрали из стандартных электродов 1-го рода медно-цинковый гальванический элемент, используя два химических стакана, емкостью 100мл, 1 М растворы солей ZnSO4 и CuSO4, предварительно протравленные электроды из меди и цинка. Электролиты соединили электролитическим мостиком. Значение ЭДС определили с помощью цифрового милливольтметра.
2.2. При анализе результатов опыта ответить на вопросы:
1. Составить электрохимическую схему исследованного гальванического элемента в молекулярной и ионной формах, уравнения анодно-катодных процессов и суммарное уравнение токообразующей реакции. Запишите значение измеренной стандартной ЭДС.
________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Используя данные табл. П.3, рассчитайте значение стандартной ЭДС и сравните с экспериментальным. Рассчитайте изменение свободной энергии Гиббса (∆G0), максимально полезную работу (Ам) и константу равновесия (КР).
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Не проводя эксперимента, рассчитайте значения ЭДС исследуемого элемента при концентрациях растворов:
а) 0,001 М ZnSO4 и 1 М СuSO4;
б)1 М ZnSO4 и 0,001 M СuSO4.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сравнить полученные значения ЭДС с величиной стандартной ЭДС и сделать выводо влиянии концентраций потенциалопределяющих ионов на величины электродных потенциалов и значения ЭДС.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Как изменятся процессы, если Zn- и Cu-электроды (оба) поместить в один и тот же раствор серной кислоты (H2SO4)? Как называется такой элемент? Ответ обосновать приведением электрохимической схемы элемента, уравнений анодно-катодных процессов и токообразующей реакции.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Объяснить, почему с течением времени в таком элементе значение ЭДС уменьшается? Какая поляризация имеет место в элементе Вольта? Какими способами можно уменьшить поляризацию и увеличить численное значение ЭДС?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Сделать обобщающий вывод, от каких факторов зависит численное значение ЭДС химических гальванических элементов.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Электролиз растворов солей на инертных электродах
Ход и данные опыта
В опыте исследовали реакции, протекающие на графитовых электродах при прохождении постоянного тока через растворы солей CuSO4, KI, NaCl. При выполнении работы использовали: электролизер (U‑образная стеклянная трубка, закрепленная в штативе), графитовые электроды, выпрямитель тока Е‑24М или ИЭПП‑2 и 0,5 М растворы солей CuSO4, KI, NaCl.
Электролиз сульфата меди. Напряжение 13-20 В, в течение 2-3 мин. На катоде выделилась медь, на аноде наблюдали выделение пузырьков газа. В анодное пространство опустили полоску индикаторной бумаги и по цветовой эталонной шкале определили значение рН раствора.
Электролиз иодида калия. Опыт проводили, используя предыдущую методику, наблюдая выделение пузырьков газа на катоде и окрашивание в светлокоричневый цвет анодного электролита. После добавления в катодное пространство фенолфталеина, в анодное – крахмала, растворы приобрели малиновый и синий цвета соответственно.
Электролиз хлорида натрия. Используя методику предыдущих опытов провели электролиз, наблюдая выделение пузырьков газа как на аноде, так и
на катоде. После добавления в катодное пространство фенолфталеина, в анодное иодокрахмального раствора (КJ + крахмал) наблюдали малиновую окраску католита и синюю – анолита.