Спирты.
План.
1. Классификация спиртов. Гомологический ряд предельных одноатомных спиртов.
2. Номенклатура и изомерия предельных одноатомных спиртов.
3. Физические свойства. Физиологическое действие.
4. Состав и строение молекулы этанола.
5. Химические свойства.
6. Получение и применение.
7. Многоатомные спирты. Особенности строения, номенклатура, изомерия.
8. Строение, физические и химические свойства глицерина.
9. Получение, применение глицерина и его роль в живых организмах.
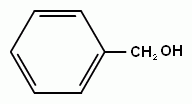
1.Соединения алифатического ряда, содержащие одну или несколько гидроксогрупп, называются спиртами (если в молекуле нет более старших функциональных групп). Если молекула содержит одну гидроксогруппу, то спирт называется одноатомным, если две – двухатомным, три – трехатомным и т.д. Для одноатомных спиртов общая формула: R-OH, где R- углеводородный алифатический радикал. Он может быть предельным, непредельным и даже содержать ароматическое кольцо. Тогда спирты так и называют: предельные, непредельные или ароматические. Если группа –ОН посредственно соединена с бензольным кольцом, то производные будут называться фенолами. Кроме того, различают первичные, вторичные и третичные спирты, в зависимости от того с каким атомом углерода соединена группа –ОН.

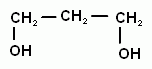

 1) 2) 3) 4)
1) 2) 3) 4)



 5) 6) 7)
5) 6) 7)
Мы начнем изучение спиртов с группы предельных одноатомных спиртов. Т.е. радикал является остатком предельного углеводорода, и в молекуле спирта только одна гидроксогруппа.

 2. Номенклатура и изомерия предельных одноатомных спиртов. Наличие гидроксогруппы (если она главная) обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа. Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 существует четыре изомерных спирта, для С5 их восемь, а для С10 уже 567.
2. Номенклатура и изомерия предельных одноатомных спиртов. Наличие гидроксогруппы (если она главная) обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа. Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 существует четыре изомерных спирта, для С5 их восемь, а для С10 уже 567.
 1) 2)
1) 2) 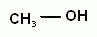 3)
3)  4) 5)
4) 5)


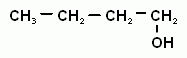
 6) 7) 8) 9)
6) 7) 8) 9)
 3. Физические свойства. Среди спиртов нет газов. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78,15о (такой спирт содержит 95,5% спирта (по массе) и называется ректификатом). Безводный этиловый спирт можно получить, связывая воду химически. Обычно концентрацию спирта выражают не в массовых долях (процентах), а в объемных. Объемные проценты называют градусами. При смешивании спирта и воды общий объем уменьшается, и эти величины не совпадают. Например, спирт-ректификат имеет крепость 96о. Т.о. при н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом. Спирты, содержащие более 15 атомов углерода являются твердыми веществами и запаха не имеют.
3. Физические свойства. Среди спиртов нет газов. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78,15о (такой спирт содержит 95,5% спирта (по массе) и называется ректификатом). Безводный этиловый спирт можно получить, связывая воду химически. Обычно концентрацию спирта выражают не в массовых долях (процентах), а в объемных. Объемные проценты называют градусами. При смешивании спирта и воды общий объем уменьшается, и эти величины не совпадают. Например, спирт-ректификат имеет крепость 96о. Т.о. при н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом. Спирты, содержащие более 15 атомов углерода являются твердыми веществами и запаха не имеют.
Спирты могут растворяться в воде. (Почему?) Первые три члена гомологического ряда (метанол, этанол, пропанол) неограниченно растворимы в воде. С увеличением углеводородного радикала растворимость спиртов падает. Высшие спирты не растворимы в воде. Сами спирты являются хорошими растворителями для органических и для неорганических веществ.
Физиологическое действие спиртов. В растворах спиртов денатурирует белок. Метанол ( метиловый или древесный спирт) СН3ОН – сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту. Попадание в организм даже небольших (5-10 г) количеств метанола вызывает слепоту, а дозы от 30 г приводят к смертельному исходу. Этанол (виноградный или медицинский спирт) С2H5OH обладает наркотическим (затормаживаются реакции, нарушается координация, появляется эффект привыкания) и обезболивающим действием. При систематическом потреблении вызывает глубокие нарушения работы ЖКТ, печени, сердечно- сосудистой системы, разрушение нервной системы. В больших количествах и одноразовый прием - смертельно опасен (около 6—8 г/кг массы тела).
4. Строение молекулы этанола. С2H5/→O ←H или С2H5→O ←/H
С появлением гидроксогруппы в молекуле спирта появляются две сильно полярные связи. Причем электронная плотность в обоих связях смещена к более электроотрицательному кислороду и на нем находится избыток электронной плотности. А на атоме водорода образуется частичный положительный заряд. Полярные связи рвутся легче, чем неполярные. Здесь у нас есть два варианта. Или образуется нуклеофильная группа гидроксогруппа ОН- и электрофил С2H5. Или образуется нуклеофильная группа OС2H5 и электрофил Н+.
5. Химические свойства.
1). Для спиртов возможна реакция замещения водорода на натрий (SЕ):
С2H5OH + Na  С2H5ONa + H2
С2H5ONa + H2
В этой реакции проявляются кислотные свойства спиртов, образующиеся вещества называют алкоголятами (этилат натрия). Но спирты нельзя назвать кислотами, потому что растворы спиртов имеют нейтральную реакцию, и со щелочами они не взаимодействуют.
2). Но для спиртов более характерны реакции замещения гидроксогруппы (SN), например, с галогеноводородами или молекулой другого спирта (образование простых эфиров).
С2H5 OH + H Cl → С2H5Cl + H-OH
С2H5 OH + С2H5O H ↔ С2H5-O-С2H5+ H2O реакция идет при нагревании до 140 
3). Кроме того, для спиртов возможны реакции отщепления (элиминирования Е).
СН3-СН2ОН → СН2=СН2 + H2O Эта реакция идет при нагревании выше 140  в присутствии конц. серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
в присутствии конц. серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
4). Как и все органические вещества спирты легко окисляются при повышенной температуре в присутствии воздуха.
С2H5OH + О2  СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
СO2 + H2O, причем ∆Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
При действии более мягких окислителей из спирта образуются альдегиды (из первичного) или кетоны (из вторичного). Например:
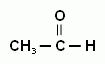
СH3-CH2-OH + CuO → + Cu + H2O
Третичный спирт окисляется только при жестких условиях с разрывом связи С-С и образованием нескольких кислот.
Получение спиртов.
1. Метанол получают из синтез-газа (смеси СО и Н2) или при сухой перегонке древесины.
СО + Н2 → СН3ОН при 220  , давление, катализатор Cu, ZnO.
, давление, катализатор Cu, ZnO.
2. Этиловый спирт в промышленности получают брожением углеводов (пищевой спирт) или гидратацией алкенов (технический спирт).
(-С6Н10O5-)n (крахмал 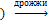 СН3-СН2ОН + СО2
СН3-СН2ОН + СО2
СН2=СН2 + H2O→ СН3-СН2ОН
3. В лаборатории можно получать спирт из галогенопроизводных, обрабатывая их водным раствором щелочи или восстановлением альдегидов.
С2H5Cl + H-OH → С2H5OH + HCl
СH3-CH=O + H2→ СH3-CH2-OH
Применение.
Метанол подвижная жидкость, запах очень похож на запах этанола, легко воспламеняется. Широко используется как растворитель. В органическом синтезе используют для получения формальдегида, а из него полимеров). Может использоваться как добавка к бензину.
Этанол – в технике, парфюмерии, в пищевой и медицинской промышленности используется как очень хороший растворитель. Этиловый спирт – важное сырье для органического синтеза (каучук, сложные эфиры, синтетические волокна…). Кроме того, спирт в медицине используется как обезболивающее (общая нечувствительность) и дезинфицирующее средство (денатурирует белок). К спирту, который используется для технически целей, добавляют различные красители, другие спирты, формалин. Такой спирт называют денатурированным. Денатурат очень ядовит.
 7. Многоатомными называют спирты, имеющие несколько групп –ОН. Различают гомологические ряды двухатомных спиртов, трехатомных и т.д. В названии многоатомных спиртов используют множительную приставку в суффиксе: ди-, три-, тетра- и т.д., Например:
7. Многоатомными называют спирты, имеющие несколько групп –ОН. Различают гомологические ряды двухатомных спиртов, трехатомных и т.д. В названии многоатомных спиртов используют множительную приставку в суффиксе: ди-, три-, тетра- и т.д., Например:
СН2ОН—СН2ОН – этандиол или этиленгликоль
СН2ОН—СН2 —СН2ОН – пропандиол-1,3
СН2ОН—СНОН—СН3 - пропандиол-1,2 и т.д.
Обратите внимание: группы ОН- всегда находятся у разных атомов углерода.
8. Наиболее важным из многоатомных спиртов является простейший трехатомный спирт - пропантриол -1,2,3, называемый просто глицерином:
СН2ОН—СНОН—СН2ОН.
Физические свойства. Глицерин — сиропообразная бесцветная жидкость сладкого вкуса; температура замерзания 17°, кипения 290°С; плотность его 1,26.Глицерин неограниченно смешивается с водой и спиртом, но нерастворим в эфире и хлороформе; сам способен растворять многие органические (сахар), а также и неорганические соединения (многие соли, например гипс). При смешивании с водой происходит уменьшение объёма (контракция), достигающее наибольшего значения для смеси, содержащей 57% глицерина; при этом выделяется тепло. Чистый глицерин гигроскопичен, он поглощает до 40% воды (по весу). Водные растворы глицерина замерзают при низких температурах, например, смесь, содержащая 66, 7% глицерина, замерзает при минус 46,5°С.
Химические свойства глицерина определяются наличием в его молекуле трех гидроксильных групп, благодаря чему он может давать три ряда производных, (причем моно- и ди-производные могут существовать в двух структурно-изомерных формах).
Монопроизводные глицерина типа СН2Х—СНОН—СН2ОН
дипроизводные СН2Х—СНХ—СН2ОН.
и трипроизводные СН2Х—СНХ—СН2Х
1). Для глицерина характерны реакции нуклеофильного замещения спиртовых функциональных групп. Например, при взаимодействии глицерина с хлороводородом:
СН2 ОН -СН ОН -СН2 ОН + 3H Cl => СН2Cl-СНCl-СН2Cl + 3H-ОН
т.е. может образоваться 1,2,3-трихлорпропан (один из вариантов).
2). При действии на глицерин не только активных металлов (натрий), но даже оксидов и гидроксидов тяжелых металлов могут получаться производные глицерина — глицераты металлов, например меди. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов.
СН2ОН—СНОН—СН2ОН + Na => СН2ОН—СНОН—СН2О-Na + H2
Или СН2ОН—СНОН—СН2ОН + Cu(OH)2↓ => образуется растворимое комплексное соединение синего цвета
9. Нахождение в природе и получение. Глицерин был открыт в 1779 г. Шееле. В свободном состоянии глицерин в небольших количествах содержится в крови животных.
Природные жиры и масла состоят из сложных эфиров глицерина и карбоновых кислот. Под действием различных катализаторов жиры в организме расщепляются на глицерин и кислоты (это реакция гидролиза жиров).
В настоящее время в промышленном производстве синтетического глицерина используют непищевое сырье (природные предельные углеводороды).
Применение: Глицерин находит широкое применение в медицине и производстве фармацевтических препаратов. Его используют для растворения веществ. Глицерин является отличным растворителем йода, брома, фенола и т.д. Используя глицерин вместо воды, можно приготовить высококонцентрированные медицинские растворы. Глицерин обладает антисептическими свойствами, поэтому его применяют для предотвращения заражения ран. Антисептические и консервирующие свойства глицерина связаны с его гигроскопичностью, благодаря которой происходит дегидратация бактерий. Безводный глицерин гигроскопичен, может вызвать ожег кожи, т.к. отнимает от нее воду, а водный раствор глицерина используют для смягчения кожи, предохранения от высыхания мазей, паст и кремов. В медицине используют также тринитроглицерин, он расширяет кровеносные сосуды.
При получении пластмасс и смол глицерин является ценным сырьем. Эфиры глицерина широко применяют в производстве прозрачных упаковочных материалов. Например, целлофан обладает отличной гибкостью и не теряет своих свойств ни в жаре, ни в холоде. При получении водонепроницаемых упаковочных материалов применяют композицию, состоящую из глицерина, протеиновых веществ, льняного масла и пигмента. С целью придания бумажным упаковочным материалам огнестойкости их пропитывают под давлением водным раствором глицерина.
В пищевой промышленности глицерин используют для приготовления экстрактов чая, кофе, имбиря и других растительных веществ. Глицерин широко применяют при производстве безалкогольных напитков. Крупные предприятия производящие алкогольные напитки расходуют более 450 т глицерина высшего сорта в год для приготовления экстракта, который в разбавленном состоянии придает напиткам "мягкость ". Глицерин используют при получении горчицы, желе и уксуса. Применяют глицерин для получения пищевых поверхностно-активных веществ (ПАВ), используемых в качестве добавок, способствующих повышению качества готовой продукции. При выработке хлебобулочных изделий ПАВ способствуют равномерному распределению жиров в тесте, предотвращают слипание клейковины и крахмала при выпечке. В связи с этим увеличивается объем хлеба и замедляется его очерствение. При производстве кондитерских изделий ПАВ уменьшают прилипание карамели, не допускают "поседения" шоколада в процессе хранения. При выработке мороженого ПАВ позволяют получить более тонкую структуру, хорошую твердость и постоянную форму продукта. В макаронных изделиях ПАВ уменьшают клейкость крахмала. ПАВ в больших количествах применяют при производстве маргарина. Они играют роль высокотемпературных стабилизаторов и эмульгаторов
Сельское хозяйство Глицерин используют при обработке семян и сеянцев, разбавленные растворы глицерина помогают прорастанию семян и укоренению саженцев.
Электротехника и радиотехника. В радиотехнике глицерин широко используют в производстве электролитических конденсаторов. Глицерин применяют при обработке алюминия и его сплавов. Глицерин используют при производстве алкидных смол, которые применяют как изоляционный материал.
В текстильной промышленности глицерин применяют в прядении, ткачестве, печатании, крашении и шлихтовании. Глицерин придает тканям эластичность и мягкость. Его используют для получения анилиновых красок, растворителей для красок, а также в качестве антисептической и гигроскопической добавки к краскам для печатания. Глицерин широко используют при производстве синтетического шелка и шерсти. В бумажной промышленности глицерин применяют при выпуске кальки, пергамента, папиросной бумаги, бумажных салфеток и жиронепроницаемой бумаги. В кожевенной промышленности глицерин добавляют к водным растворам хлорида бария, который используют в качестве препарата для консервирования кож. Глицерин является одним из компонентов восковых эмульсий для дубления кож. В процессе жировки кож используют глицериновые растворы
Лакокрасочная промышленность. Глицерин - ценный компонент полировочных составов, особенно лаков, применяемых для окончательной отделки. В процессе этерификации канифоли с глицерином образуется продукт, используемый для производства различных лаков. Многоосновные кислоты при конденсации с глицерином образовывают смолообразные продукты, называемые глифталями. Глицерин 98 %-ный применяют для производства электроизоляционных лаков.
Производство моющих и косметических средств. Большое количество сортов туалетного мыла и различные кремы содержат глицерин, который усиливает моющую способность, придает белизну коже и смягчает ее. Глицериновое мыло способствует удалению красящих веществ кожи, загоревшей на солнце. Многие прозрачные сорта туалетного мыла имеют массовую долю глицерина 8-15 %.
Военное дело. Глицерин используют для получения нитроглицерина, из которого производят динамит, бездымный порох и другие взрывчатые вещества, применяемые в мирных целях и военном деле. Кроме того, динамитный глицерин используют в качестве незамерзающих растворов в различных двигателях, тормозной и нагревающей жидкости, для охлаждения стволов орудий.
Задания для самостоятельной домашней работы.
1. Прочитайте текст, найдите ответы на вопросы.
1) Какие производные углеводородов относят к спиртам, а какие к фенолам?
2) В чем особенность строения предельных одноатомных спиртов? Какие виды изомерии для них характерны?
3) Что получается при окислении спиртов?
4) Почему для спиртов характерны реакции замещения?
5) Какие физические свойства характерны для спиртов? Ответ поясните с т.з. строения вещества.
6) Как получают спирты из углеводородов? Предложите ряд реакций получения спирта из алканов?
7) Для чего используют этиловый спирт?
8) В чем особенность строения глицерина?
9) Сравните химические свойства этанола и глицерина.
10) Опишите физические свойства глицерина. Почему у него такая высокая температура кипения?