1. Осмотическим называется давление, наблюдаемое в растворах и вызываемое ударами частиц (молекул или ионов) растворенного вещества о стенки сосуда.
Осмотическое давление можно обнаружить и измерить, отделив раствор от чистого растворителя полупроницаемой перегородкой.
Осмотическое давление разбавленных растворов подчиняется законам идеального газа.
Осмотическое давление разбавленных растворов при постоянной температуре прямо пропорционально концентрации вещества с (закон Бойля-Мариотта)
p = const c или 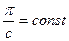 при t = const.
при t = const.
Осмотическое давление разбавленных растворов при постоянной концентрации прямо пропорционально абсолютной температуре (закон Гей-Люссака)
p = const/ Т или 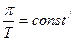 при с = const.
при с = const.
Два раствора различных веществ при одинаковой температуре и молярной концентрации обладают одинаковым осмотическим давлением и называются изотоническими (закон Авогадро).
К разбавленным растворам также применимо уравнение Д.И. Менделеева
p = сRT,
где с – концентрация раствора, моль/л,
Т – абсолютная температура,
R – газовая постоянная.
2. По закону Рауля относительное понижение давления пара растворителя над раствором равно отношению числа молей растворенного вещества к сумме числа молей растворителя и растворенного вещества.

где  - давление пара над чистым растворителем при данной
- давление пара над чистым растворителем при данной
температуре;
РА – парциальное давление пара растворителя над раствором при той
же температуре;
nb - число молей растворенного вещества;
na - число молей растворителя.
Для очень разбавленных растворов nb по сравнению с na весьма мало и поэтому данной величиной в знаменателе можно пренебречь.
3. Закон Генри выражает зависимость растворимости газа от давления выражается законом Генри: в единице объема растворителя при постоянной температуре растворяется одинаковый объем данного газа независимо от давления.
Количество растворенного газа в жидкости пропорционально его давлению над раствором.
Сж = Кр
где сж – весовая концентрация газа в растворе;
р – давление газа над раствором;
К – коэффициент пропорциональности, характеризующий растворимость, не зависит от давления, но изменяется с температурой. На растворимость газов в жидкостях влияют многие факторы – природа газа, природа растворителя, присутствие посторонних веществ, температура и давление. Зависимость
Растворение в жидкостях смеси газов подчиняется закону Дальтона, в соответствии с которым весовая концентрация каждого из газов в растворе пропорциональна парциальному давлению его в газовой фазе.
Растворимость газов в жидкостях чаще всего выражается:
а) объемом газа, растворяющимся в 1 объеме растворителя при общем давлении (газа и паров жидкости), равном 101325 н/м2 (коэффициент растворимости l, или S);
б) объемом газа, приведенным к нормальным условиям и поглощаемым 1 объемом растворителя при парциальном давлении газа, равном 101325 н/м2 (коэффициент абсорбции a);
в) количеством граммов газа, растворяющимся в 100 г растворителя при общем давлении 101325 н/м2 (обозначается q);
г) количеством газа (г или мг) в 1 л растворителя;
д) объемом газа (см3) (приведенным к нормальным условиям), поглощенным 1 г растворителя при указанной температуре и парциальном давлении газа, равном 101325 н/м2 (обозначается b).
Под растворимостью газов, называемой также коэффициентом растворимости, понимают отношение концентрации газа в жидкости сж к концентрации газа в газовой фазе сгаз
 .
.
 .
.
4. Вследствие понижения давления пара растворителя над растворами нелетучих или мало летучих веществ температура замерзания растворов ниже, а температуры кипения выше чем у чистых растворителей.
Понижение температуры замерзания раствора DТ3, равное разности температура замерзания растворителя и раствора DТ3 = Т3 р-ля – Т3 р-ра, прямо пропорционально моляльной концентрации растворенного вещества с
DТ3 = Екс,
или

где Ек – коэффициент пропорциональности, называемый молекулярным
понижением температуры замерзания растворителя или
криоскопической постоянной;
М – молекулярный вес вещества;
m1 - масса растворенного вещества;
m2 - масса растворителя.
Криоскопическая постоянная равна понижению температуры замерзания при содержании в 1000 г растворителя 1 моль растворенного вещества.
Определив опытным путем понижение температуры замерзания раствора и используя формулу, можно рассчитать молекулярный вес растворенного вещества – не электролита. Этот метод широко применяется в лабораторной практике.
Повышение температуры кипения раствора DТК , равное разности между температурами кипения раствора (ТК р-ра) и растворителя (ТК рля), прямо пропорционально моляльной концентрации растворенного вещества
DТК = ЕКс,
где ЕК – молекулярное повышение температуры кипения растворителя,
или эбуллиоскопическая постоянная.
Для m г растворенного вещества и г растворителя

Определив опытным путем повышение температуры кипения раствора по сравнению с чистым растворителем, можно по формуле вычислить молекулярный вес растворенного вещества – не электролита.
Криоскопические и эбуллиоскопические постоянные Е3 и ЕК не зависят от природы растворенных веществ, а зависят только лишь от природы растворителей
При отсутствии табличных данных Еэ и ЕК можно рассчитать теоретически:
 ;
;
 ;
;
где Т3 – температура замерзания растворителя, 0С;
ТК – нормальная температура кипения растворителя,
R - удельная теплота плавления, дж/г;
l - удельная теплота испарения, дж/г;
R - газовая постоянная, равная 8,313 дж/(град×моль).