Список учебной литературы
1. Кудряшов И.В., Каретников Г.С. Сборник примеров и задач по физической химии. М.: Высшая школа, 1991, 527 с. (КК)
2. Кудряшов И.В. Задания по физической химии /МХТИ им.Д.И.Менделеева, М., 1986, 37 с.
3. Краткий справочник физико-химических величин / Под ред. А.А.Равделя и А.М.Поно-маревой. СПб.: Иван Федоров, 2003, 240 с. (Р). -
4. Атанасянц А.Г., Белевский С.Ф. и др. Сборник вопросов и задач по физической химии для самоконтроля / Под ред. С.Ф.Белевского. М.: Высшая школа, 1979, 118с.
Первый и второй законы термодинамики
Занятия 1,2. Идеальные газы, уравнение состояния идеальных газов. Газовая постоянная. I закон термодинамики. Функции состояния и функции процесса. Расчет работы расшире-ния в изобарном, изотермическом, адиабатном процессах. Графическая интерпретация работы расширения. Взаимосвязь теплоты, работы и изменения внутренней энергии в процессах с участием идеального газа. Теплоемкость, степенные (температурные) ряды. Зависимость энтальпии и внутренней энергии вещества от температуры. Закон Гесса и следствия из закона Гесса. Обоснование следствий из закона Гесса. Расчет тепловых эффе-ктов химических реакций при  и
и  и теплоты фазовых превращений при
и теплоты фазовых превращений при  с помощью таблиц стандартных термодинамических величин. Определение теп-лоты образования вещества по данным о его теплоте сгорания. Таблицы: [3], №№ 30,40,44.
с помощью таблиц стандартных термодинамических величин. Определение теп-лоты образования вещества по данным о его теплоте сгорания. Таблицы: [3], №№ 30,40,44.
Домашнее задание: [I], с.66, № 1,2 или [2], № 5.
Занятие 3. Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа. Графический анализ зависимости теплового эффекта от температуры с учетом зависимостей сумм теплоемкостей реагентов от температуры.  Расчет тепловых эффектов реакций, теплоты образования и теплоты фазовых переходов при заданной темпе-ратуре с использованием справочных данных. Таблицы: [3], №№ 30,40,44.
Расчет тепловых эффектов реакций, теплоты образования и теплоты фазовых переходов при заданной темпе-ратуре с использованием справочных данных. Таблицы: [3], №№ 30,40,44.
Домашнее задание: [I], с.68, № 4 или [2], № 6.
Занятие 4. Итоговое занятие по теме: «Первый закон термодинамики».
Занятие 5. Второй закон термодинамики. Энтропия. Зависимость энтропии от темпе-ратуры и давления. Изменение энтропии в различных расширения (сжатия) и нагревания (охлаждения) индивидуальных веществ. Изменение энтропии при фазовых превращениях и смешении идеальных газов. Абсолютная энтропия вещества. Расчет абсолютной энтропии вещества при заданной температуре и давлении. Расчет изменения энтропии в химических реакциях при заданной температуре. Таблицы: [3], №44.
Домашнее задание: [I], с.90, № 23; с.95, № 4 или [2], № 7.
Занятие 6. Энергия Гиббса (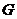 ). Энергия Гельмгольца (
). Энергия Гельмгольца ( ). Зависимость функций
). Зависимость функций 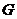 и
и  от температуры, давления, объема. Изменение функций
от температуры, давления, объема. Изменение функций 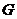 и
и  в различных процессах с участием индивидуальных веществ. Расчет
в различных процессах с участием индивидуальных веществ. Расчет  и
и  для химических процессов. Использование таблиц стандартных термодинамических величин для расчета
для химических процессов. Использование таблиц стандартных термодинамических величин для расчета  и
и  химических реакций при различных температурах. Таблицы: [3], №44,45.
химических реакций при различных температурах. Таблицы: [3], №44,45.
Домашнее задание: [I], с. 92, №34: с.93, № 39 или [2], № 8.
Занятие 7. Итоговое занятие по теме: «Второй закон термодинамики».
Химическое равновесие
Занятие 8. Расчет эмпирической константы химического равновесия из эксперимен-тальных данных о равновесных давлениях и концентрациях реагентов. Взаимосвязь эмпирических констант равновесия  и стандартной константы равновесия
и стандартной константы равновесия 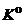 (термодинамическая константа равновесия) для реакций с участием идеальных газов. Нахождение состава равновесной смеси (равновесного выхода продукта реакции, степени превращения и степени диссоциации вещества) на основании величины константы химического равновесия (для гомогенных и гетерогенных реакций). Влияние давления и примеси инертного газа на смещение химического равновесия (равновесный выход продукта реакции).
(термодинамическая константа равновесия) для реакций с участием идеальных газов. Нахождение состава равновесной смеси (равновесного выхода продукта реакции, степени превращения и степени диссоциации вещества) на основании величины константы химического равновесия (для гомогенных и гетерогенных реакций). Влияние давления и примеси инертного газа на смещение химического равновесия (равновесный выход продукта реакции).
Домашнее задание: [1], с.283, №1 или [2], № 13.
Занятия 9,10. Стандартное химическое сродство. Определение направления самопроиз-вольного протекания химической реакции при  ,
, 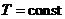 на основании уравнения изотермы Вант-Гоффа. Влияние температуры на константу химического равновесия, урав-нение изобары Вант-Гоффа. Вычисление константы равновесия химической реакции при некоторой температуре
на основании уравнения изотермы Вант-Гоффа. Влияние температуры на константу химического равновесия, урав-нение изобары Вант-Гоффа. Вычисление константы равновесия химической реакции при некоторой температуре  по ее значению при другой температуре
по ее значению при другой температуре  и среднему значению энтальпии реакции в данном интервале температур. Определение термодинамических характеристик химической реакции (энтальпии, энтропии, энергии Гиббса) из эксперимен-тальной зависимости константы равновесия от температуры. Расчет
и среднему значению энтальпии реакции в данном интервале температур. Определение термодинамических характеристик химической реакции (энтальпии, энтропии, энергии Гиббса) из эксперимен-тальной зависимости константы равновесия от температуры. Расчет  и стандартной (термодинамической) константы химического равновесия при различных температурах с помощью таблиц стандартных термодинамических величин. Использование метода Темкина-Шварцмана, метода комбинирования уравнений химических реакций, справочных данных о логарифмах констант равновесия реакций образования соединений из простых веществ для нахождения константы равновесия данной химической реакции. Таблицы: [3], №№ 41,44,45,49,50.
и стандартной (термодинамической) константы химического равновесия при различных температурах с помощью таблиц стандартных термодинамических величин. Использование метода Темкина-Шварцмана, метода комбинирования уравнений химических реакций, справочных данных о логарифмах констант равновесия реакций образования соединений из простых веществ для нахождения константы равновесия данной химической реакции. Таблицы: [3], №№ 41,44,45,49,50.
Домашнее задание: [1], с.285, № 4 или [2], № 14,15.
Фазовое равновесие в однокомпонентных системах.
Занятие 11. Диаграмма фазового равновесия однокомпонентной системы (диаграмма с тройной точкой). Правило фаз Гиббса. Определение числа степеней свободы в заданной фазовой области. Уравнение Клапейрона-Клаузиуса. Расчет давления насыщенного пара и теплоты испарения (возгонки) при заданной температуре на основании справочных данных о температурах кипения (возгонки) веществ при давлении ниже атмосферного. Нахождение координат тройной точки по температурной зависимости давления насыщенного пара веще-ства. Расчет температуры плавления (кристаллизации) вещества при заданном внешнем давлении (в приближении линейной зависимости температуры плавления от давления). Вычисление термодинамических функций фазовых превращений ( ,
,  ,
,  ,
,  и
и  ) на основании экспериментальных зависимостей давления насыщенного параоттемпературы. Таблицы: [3], №№ 21,24,25.
) на основании экспериментальных зависимостей давления насыщенного параоттемпературы. Таблицы: [3], №№ 21,24,25.
Домашнее задание: [I], с. 166, № 1 или [2], № 9.
Занятие 12. Итоговое занятие по темам «Химическое и фазовое равновесие».
Растворы неэлектролитов
Занятие 13. Термодинамическая теория растворов. Парциальные молярные величины (свойства), аналитические и графические методы определения парциальных молярных величин. Расчет парциальных молярных свойств компонентов из экспериментальных зависимостей экстенсивного свойства раствора от концентрации. Уравнения Гиббса-Дюгема. Использование этих уравнений для нахождения интегрального свойства раствора. Расчет изменения объема, энтальпии, энтропии, энергии Гиббса при образовании бинарного идеального раствора. Закон Рауля. Расчет активностей, коэффициентов активности и отно-сительного химического потенциала компонентов раствора по экспериментальной зависи-мости давления насыщенного пара от концентрации для стандартного состояния "чистое вещество”. Расчет термодинамических функций смешения для реальных растворов при заданной температуре. Таблицы [3], №№ 20,21,31,36
Домашнее задание: [I], с.191, № 2 или [2], №10
Занятие 14. Коллигативные свойства разбавленных растворов нелетучихвеществ. Вычисление относительного понижения давления пара растворителя, повышения температуры начала кипения, понижения температуры начала отвердевания, осмотического давления для разбавленного раствора нелетучего вещества в летучем растворителе при данной концентрации раствора. Определение величины какого-либо колл гативного свойства разбавленного раствора нелетучего вещества в летучем растворителе по значению другого коллигативного свойства. Изотонический коэффициент. Расчеты молярной массы и степени диссоциации (ассоциации) нелетучего растворенного вещества.
Таблицы: [3], № 20,21.
Домашнее задание: [I], с.206, № 1 или [2], №10
Занятие 15. Итоговое занятие по теме «Растворы неэлектролитов ».