9). Белки острой фазы - группа белков концентрация, которых возрастает при наличии воспаления, сдавления, ожога,бактериальной или вирусной инфекции. - С-реактивного белка (С-РБ) - сывороточного предшественника амилоида A (SAP) - компонентов комплемента - альфа-1-гликопротеина - церулоплазмина - альфа-1-антиприпсина - альфа-макроглобулинов - фибриногена - протромбина - фактора VII - плазминогена - гаптоглобина - иммуноглобулинов - ферритина Синтез белков острой фазы активируется под действием провоспалительных цитокинов (интерлейкины — 1, 6, 11, факторы некроза опухолей, интерферон гамма), представляет собой универсальную защитную реакцию и наблюдается не только при инфекционных процессах, но и при травмах, обширных ожогах и интоксикациях. Белки острой фазы синтезируются в печени и их уровень резко, в несколько сотен раз повышается при наличии любого повреждения тканей, вызванного вирусами, бактериями, антителами, некрозом. Данные белки запускают каскад реакций для отграничения воспалительного очага, от неповрежденных тканей. Большинство прочих белков плазмы крови относится к глобулинам. Среди них различают: a-глобулины, связывающие тироксин (см. ТИРОКСИН) и билирубин; b-глобулины, связывающие железо, холестерол и витамины A, D и K; g-глобулины, связывающие гистамин (см.ГИСТАМИН) и играющие важную роль в иммунологических реакциях организма, поэтому их иначе называют иммуноглобулинами (см. ИММУНОГЛОБУЛИНЫ) или антителами. Известны 5 основных классов иммуноглобулинов, наиболее часто встречающиеся из них IgG, IgA, IgM. Уменьшение и увеличение концентрации иммуноглобулинов в плазме крови может иметь как физиологический, так и патологический характер. Известны различные наследственные и приобретенные нарушения синтеза иммуноглобулинов. Снижение их количества часто она возникает при злокачественных заболеваниях крови, таких как хронический лимфатический лейкоз (см. ЛЕЙКОЗ), множественная миелома (см. МИЕЛОМНАЯ БОЛЕЗНЬ), болезнь Ходжкина; может быть следствием применения цитостатических препаратов или при значительных потерях белка (нефротический синдром (см. НЕФРОТИЧЕСКИЙ СИНДРОМ)). При полном отсутствие иммуноглобулинов, например, при СПИДе (см. СПИД), могут развиваться рецидивирующие бактериальные инфекции.
Повышенные концентрации иммуноглобулинов наблюдаются при острых и хронических инфекционных, а также аутоиммунных заболеваниях, например, при ревматизме (см.РЕВМАТИЗМ), системной красной волчанке и т. д. Весомую помощь в постановке диагноза многих инфекционных заболеваний оказывает выявление иммуноглобулинов к специфическим антигенам (иммунодиагностика (см. ИММУНОДИАГНОСТИКА)).
10). Всякое нарушение соотношения между отдельными белками и количественными изменениями в содержании плазменных белков и есть диспротеинемия. Гипопротеинемия - явление частое и сочетается с гипоальбуминемией. Гипопротеинемия встречается при ускоренном распаде отдельных белков, врожденном или приобретенном нарушении синтеза отдельных белков, уменьшении синтеза вследствие недостатка или качественной диспропорции аминокислот (голодание, лихорадка, нарушение усвоения белка, потеря белков, отеки, водянки, шок, ожоги,протеинурия, кровопотери). Гипопротеинемия чаще бывает преимущественно за счет альбуминов - она проявляется при различных механизмах развития гипопротеинемий. Истинная гиперпротеинемия характерна для макроглобулинемии, миеломной болезни, лейшманиозах, в отдельные периоды развития гепатитов. В остальных случаях гиперпротеинемия бывает связанной со сгущением крови. Отсюда относительная и абсолютная гиперпротеинемия. Для разделения белковых фракций используют метод электрофореза, основанный на различной подвижности белков сыворотки в электрическом поле. Методом электрофореза возможно определить различные виды белка в сыворотке крови. Отдельные белки, за исключением альбумина, обычно не определяются методом электрофореза. Однако, измеряются белковые фракции или группы (Альбумин, alfa1-alfa2-бетта-гамма-глобулин). Уровни белковых фракций можно определить путем измерения общего белка сыворотки крови и умножить на относительный процент от каждой доли белкового компонента, или автоматически с применением аппарата HellabioScan.
Электрофоре сыворотки всегда должен сопровождаться измерением сывороточных IgG, IgA и IgM концентраций. Электрофорез белков помогает выявить заболевания печени и почек, иммунной системы, некоторые злокачественные новообразования (лейкозы), острые и хронические инфекции, генетические поломки и др. Известен ряд своеобразных электрофоретических "синдромов" – типичных картин электрофореграмм, характерных для некоторых патологических состояний. Белки сыворотки разделяют методом электрофореза на альбумины и глобулины. 1. Острое воспаление с активацией системы комплемента и увеличением синтеза острофазных белков (a1-антитрипсина, гаптоглобина, фибриногена и др.). Оно проявляется увеличением доли a1- и a2-глобулинов и может быть подтверждено измерением СОЭ, исследованием концентрации С-реактивного белка, фибриногена (в динамике) и других острофазных белков. 2. Хроническое воспаление с усилением синтеза ряда острофазных белков, а также иммуноглобулинов; проявляется умеренным возрастанием a2- и b-глобулинов, повышением g-глобулинов и некоторым снижением альбумина. Подобные отклонения могут наблюдаться при хронических инфекциях, коллагенозах, аллергии, аутоиммунных процессах и при малигнизации. 11). Органические небелковые соединения плазмы делятся на две группы. I группа - азотсодержащие небелковые компоненты. В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли остаточный азот (остается после осаждения белков):
1. азот мочевины (50 %);
2. азот аминокислот (25 %);
3. низкомолекулярные пептиды;
4. креатин;
5. креатинин;
6. билирубин;
7. индикан;
8. некоторые другие азотсодержащие вещества. При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т. е. наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов. В понятие "остаточный азот" включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы). II группа - безазотистые органические вещества. К безазотистым (не содержат азот) органическим веществам плазмы крови относятся: углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.); минеральные вещества крови.
У здорового человека колебания в содержании небелкового (остаточного) азота крови незначительны и в основном зависят от количества поступающих с пищей белков. При ряде патологических состояний уровень небелкового азота в крови повышается. Это состояние носит название азотемии. Азотемия в зависимости от вызывающих ее причин подразделяется на ретенционную и продукционную. Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступлении их в кровяное русло. Она в свою очередь может быть почечной и внепочечной. Как отмечалось, в количественном отношении главным конечным продуктом обмена белков в организме является мочевина. Принято считать, что мочевина в 18 раз менее токсична, чем остальные азотистые вещества. При острой почечной недостаточности концентрация мочевины в крови достигает 50–83 ммоль/л (норма 3,3–6,6 ммоль/л). Нарастание содержания мочевины в крови до 16–20 ммоль/л (в расчете на азот мочевины) является признаком нарушения функции почек средней тяжести, до 35 ммоль/л – тяжелым и свыше 50 ммоль/л – очень тяжелым нарушением с неблагоприятным прогнозом. К важным небелковым азотистым веществам крови относится также мочевая кислота. Напомним, что у человека мочевая кислота является конечным продуктом обмена пуриновых оснований. В норме концентрация мочевой кислоты в цельной крови составляет 0,18–0,24 ммоль/л (в сыворотке крови – около 0,29 ммоль/л). Повышение содержания мочевой кислоты в крови (гиперурикемия) – главный симптом подагры. При подагре уровень мочевой кислоты в сыворотке крови возрастает до 0,5–0,9 ммоль/л и даже до 1,1 ммоль/л.
12). Внутриклеточные белки, белки секретов, поступающие в кровь при разрушении клеток разных тканей. АЛТ и АСТ функция: ферменты, катализирующие реакции трансаминирования, локализация – гепатоциты, миоциты. Для выяыления повреждения гепатоцитов (диагностика геппатитов). Щелочная фосфотаза: фермент, катализирующий реакции отщепления фосфатов от различных соединений, локализация – желчные капилляры, прогтоки; выявление: активации повреждения остеобластов, повреждения желчных путей при холестазе, обтурации желчевыводящих путей. Альфа-амилаза – Фермент, катализирующий гидролиз крахмала и гликогена в ЖКТ; локализация – поджелудочная железа, слюнные железы. Используется для выявления повреждения кл.поджелуд.жел.(диагност. панкреатита). (см на moodle)
13). Бу́ферные систе́мы кро́ви (от англ. buffer, buff — смягчать удар) — физиологические системы и механизмы, обеспечивающие кислотно-основное равновесие в крови. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов. Бикарбонатная: Мощнейшая и, вместе с тем, самая управляемая система внеклеточной жидкости и крови, на долю которой приходится около 10 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющуюся источником протона и бикарбонат-аниона HCO3−, выполняющего роль акцептора протона: H2CO3 ↔ H+ + HCO3−.
Фосфатная: остоит из слабой кислоты Н2РО4- и сопряженного основания НРО42-. В основе ее действия лежит кислотно-основное равновесие, равновесие между гидрофофсфат- и дигидрофосфат-ионами: НРО42- + Н+ Н2РО4-; НРО42- + Н2О Н2РО4- + ОН- Фосфатная буферная система способа сопротивляться изменению рН в интервале 6, 2 - 8, 2, т. е. обеспечивает значительную долю буферной емкости крови. Фосфорная буферная система имеет более высокую емкость по кислоте, чем по щелочи. Поэтому она эффективно нейтрализует кислые метаболиты, поступающие в кровь, например молочную кислоту HLac Гемеглобиновая: на долю которой приходится около 75% буферной емкости крови, характеризующаяся равновесием между ионами гемоглобина Hb- и самим гемоглобином HНb, являющимся очень слабой кислотой. Ацидоз (от лат. acidus — кислый) — cмещение кислотно-щелочного баланса организма в сторону увеличения кислотности (уменьшению рН). Обычно продукты окисления органических кислот быстро удаляются из организма. При лихорадочных заболеваниях, кишечных расстройствах, беременности, голодании и др. они задерживаются в организме, что проявляется в лёгких случаях появлением вмоче ацетоуксусной кислоты и ацетона (т. н. ацетонурия), а в тяжёлых (например, при сахарном диабете) может привести к коме. Алкало́з (позднелат. alcali щелочь, от арабск. al-quali) — нарушение кислотно-щелочного равновесия организма, характеризующееся абсолютным или относительным избытком оснований. При алкалозе (особенно связанном с гипокапнией) происходят общие и регионарные нарушения гемодинамики: уменьшается мозговой и коронарный кровоток, снижаются АД и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для газового алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
14). Формирование эритроцитов (эритропоэз) происходит в костном мозге черепа, рёбер и позвоночника, а у детей — ещё и в костном мозге в окончаниях длинных костей рук и ног. Продолжительность жизни — 3—4 месяца, разрушение (гемолиз) происходит в печении селезёнке. Прежде чем выйти в кровь, эритроциты последовательно проходят несколько стадий пролиферации и дифференцировки в составе эритрона — красного ростка кроветворения. Эритропоэз- процесс образования эритроцитов в организме. Под действием эритропоэтина в костном мозге возникает подъем эритропоэза и в результате увеличивается продукция ретикулоцитов. Основное действие эритропоэтина направлено на регуляцию входа эритропоэтинчувствительных клеток в эритрон. Он также оказывает влияние на эритроциты в различных стадиях зрелости: при введении эритропоэтина в них увеличивается включение 14С-глицина в тем, глобин и белки, а по некоторым данным сокращается время их митотического цикла. Мембрана эритроцитов: Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды, сфингофосфолипиды, гликолипиды и холестерол. Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а следовательно, и способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза. Спектрин - периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны. Интегральный белок полосы 3 - белок-переносчик ионов С1- и НСО3- через плазматическую мембрану эритроцитов по механизму пассивного антипорта. В разделе 1 подробно описана роль эритроцитов в газообмене. Поступающий из тканей в эритроциты СО2 под действием фермента карбоангидразы превращается в слабую угольную кислоту, которая распадается на Н+ и НСО3-. Образующиеся при этом протоны присоединяются к гемоглобину, уменьшая его сродство к О2, а бикарбонаты с помощью белка полосы 3 обмениваются на Cl- и выходят в плазму крови.
15). Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее(почти в 500 раз), чем кислород, образуякарбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких. Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы(порфобилиноген-синтазы) протекает в цитозоле. После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол. Различают два вида тетрапирролов - уропорфириноген типа I иуропорфириноген типа III. В синтезе обоих видов порфиринов принимает участиеуропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза. Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III окисляется в протопорфириноген IX и далее впротопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
16)- Главная функция эритроцитов - транспорт газов: перенос О2 и СО2.
-облегчает движение по узким капилярам
- защищает эти клетки от активных форм кислорода
16.2 Транспорт кислорода обеспечивается гемоглобином (Hb), на долю которого приходится ~98% массы белков цитоплазмы эритроцитов. Гемоглобин является тетрамером, в котором каждая белковая цепь несет гем - комплекс протопорфирина IX с ионом двухвалентного железа, кислород обратимо кординируется с ионом Fe2+ гемоглобина, образуя оксигемоглобин HBO2:
Hb + O2 HBO2
Особенностью связывания кислорода гемоглобином является его аллостерическое регулирование - стабильность оксигемоглобина падает в присутствии 2,3-дифосфоглицериновой кислоты - промежуточного продукта гликолиза и, в меньшей степени, углекислого газа, что способствует высвобождению кислорода в тканях, в нем нуждающихся.
(Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах. Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется оксигемоглобином) и освобождать необходимое количество кислорода в тканях. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина. При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.)
16.3Транспорт углекислого газа эритроцитами происходит с участием карбоангидразы, содержащейся в их цитоплазме. Этот фермент катализирует обратимое образование бикарбоната из воды и углекислого газа, диффундирующего в эритроциты:
H2O + CO2 H+ + HCO3-
В результате в цитоплазме накапливаются ионы водорода, однако снижение pH при этом незначительно из-за высокой буферной емкости гемоглобина. Вследствие накопления в цитоплазме ионов бикарбоната возникает градиент концентрации, однако ионы бикарбоната могут покидать клетку только при условии сохранения равновесного распределения зарядов между внутренней и внешней средой, разделенных цитоплазматической мембраной, то есть выход из эритроцита иона бикарбоната должен сопровождаться либо выходом катиона, либо входом аниона. Мембрана эритроцита практически непроницаема для катионов, но содержит хлоридные ионые каналы, в результате выход бикарбоната из эритроцита сопровождается входом в него хлорида (хлоридный сдвиг).
17. 1.Железо, попадая в организм с пищей, всасывается в кишечнике (в основном в двенадцатиперстной кишке и начальном отделе тощей кишки). Всасывание железа в ЖКТ ограничено и контролируется его концентрацией в плазме. Усиливают всасывание аскорбиновая, янтарная, пировиноградная кислоты, сорбит, алкоголь, подавляют — оксалаты, препараты кальция и содержащие кальций продукты (например, творог, молоко и т.д.).
Транспорт железа осуществляется белком трансферрином, который переносит железо в костный мозг, в места клеточных запасов железа (паренхиматозные органы, мышцы) и во все клетки организма для синтеза ферментов. Железо погибших эритроцитов фагоцитируют макрофаги.
Физиологическая потеря железа происходит с калом. Незначительная часть железа теряется с потом и клетками эпидермиса. Общая потеря железа — 1 мг/сут. Также физиологическими считают потери железа с менструальной кровью, с грудным молоком.
17.2 гемоглобин (снижается при анемии)
* эритроциты (снижаются)
* сывороточное железо (снижается)
* сывороточный ферритин (снижается)
* коэффициент насыщения трансферрина (повышается)
17.3Наблюдается в первые дни жизни ребенка. Причиной повышения концентрации
непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглащение, конъюгации, и секреции прямого билирубина. У новорожденных не только снижена активность УФА- глюкуронилтрансферазы, но и, по-видимому, недостаточно активно происходит синтез второго субстрата реакции конъюгации Удф-глюкуроната.
Известно, что УФА- глюкуронилтрансфераза – индуцируемый фермент.Новорожденный с физиологической желтухой вводят лекарственный препарат фенолобарбитал.
Одно из неприятных осложнений «физиологической желтухи» - билирубиновая энцефалопатия. Когда концентрация неконъюгированого билирубина превышает 340 мкмоль\л, он проходит через гематоэнцефалический барьер головного мозга и вызывает его поражения.
18.1
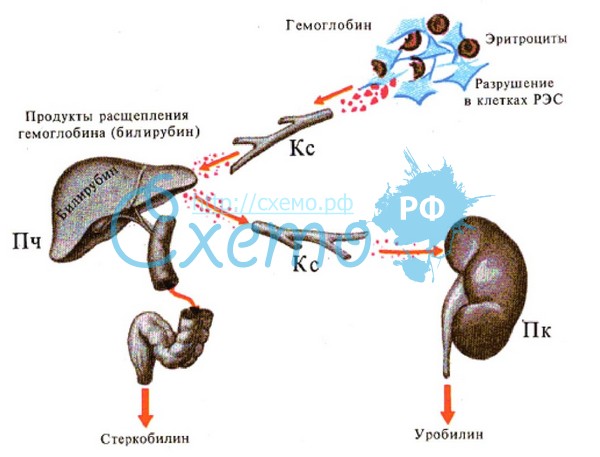

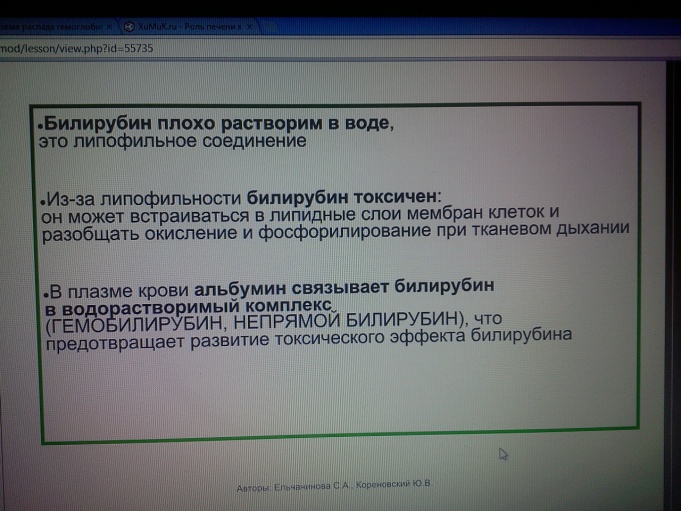


18.2 При усиленном гемолизе эритроцитов в звездчатых эндотелиоцитах печени, макрофагах селезенки, костного мозга образуется столь большое количество свободного (непрямого, неконъюгированного) билирубина, что гепатоциты печени оказываются не в состоянии полностью извлечь его из крови и связать с уридиндифосфоглюкуроновой кислотой (относительная печеночная недостаточность). Кроме того, гемолитические яды часто являются гепатотоксическими веществами, а поражение гепатоцитов затрудняет метаболизм и транспорт билирубина в них. В крови увеличивается содержание неконъюгированного билирубина (непрямая гипербилирубинемия), который не выводится с мочой из-за своей связи с альбумином. Может возрасти уровень конъюгированного (прямого) билирубина, что обусловлено его обратной диффузией в кровь после того, как способность гепатоцита экскретировать связанный билирубин в желчь оказалась исчерпанной.
При очень высокой непрямой гипербилирубинемии (260 — 550 мкмоль/л), когда не весь свободный билирубин включается в билирубин-альбуминовый комплекс, развивается так называемая ядерная желтуха (окрашивание ядер головного мозга) с поражением ядер центральной нервной системы и неврологической симптоматикой (энцефалопатия), что особенно характерна для гемолитической болезни (анемии) новорожденных при резус- несовместимости эритроцитов матери и плода. Токсическое действие свободного билирубина на нервную систему может проявиться и при незначительном повышении билирубина в крови, но наличии гипоальбуминемии, повышении проницаемости гематоэнцефалического барьера, мембран нервных клеток (при нарушении обмена липидов, гипоксии).
18.3
В свежей моче и кале содержатся уробилиногены (в кале эти соединения называют стеркобилиногенами); на воздухе они окисляются и превращаются в соответствующие уробилины — Ж. п. оранжево-желтого цвета. В клинической практике термином «уробилин» обычно называют пигменты, выводимые с мочой, а термином «стеркобилин» — пигменты, выделяемые с калом.
В крови-?
19 Гемолитическая желтуха – результат интенсивного гемолиза эритроцитов
Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Гемолитическая желтуха развивается при исчерпании резервных возможностей печени. Осн. Причина – наследственные или приобретенные гемолитические анемии.
19.2 Гемолиз бывает внутрисосудистым, когда эритроцитоц лизируются в крови, и внесосудистым - эритроциты подвергаются деструкции и перевариваются системой макрофагов. Внутрисосудистый гемолиз встречается относительно редко. Он может возникнуть вследствие механического разрушения эритроцитов при травмировании в малых кровеносных сосудах (маршевая гемоглобинурия), турбулентном кровяном потоке (дисфункция протезированных клапанов сердца), при прохождении через депозиты фибрина в артериолах (тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром, ДВС-синдром), в результате несовместимости эритроцитов по системе АВ0, резус или какой-либо другой системе (острая посттрансфузионная реакция), под влиянием комплемента (пароксизмальная ночная гемоглобинурия, пароксизмальная холодовая гемоглобинурия), вследствие прямого токсического воздействия (яд змеи кобры, инфекции), при тепловом ударе.
Внесосудистый гемолиз осуществляется преимуещственно в селезенке и печени. Селезенка способна захватывать и разрушать малоизмененные эритроциты, печень различает лишь эритроциты с большими нарушениями, однако поскольку ток крови к печени примерно в 7 раз больше, чем к селезенке, печень может играть существенную роль в гемолизе.
Удаление эритроцитов из крови макрофагами происходит в основном двумя путями. Первый механизм связан с распознаванием макрофагами эритроцитов, покрытых IgG-АТ и С3, к которым на поверхности макрофагов имеются специфические рецепторы - иммуногемолитические анемии. Фагоцитоз эритроцитов сопровождается усиленной клеточной пролиферацией в селезенке (и в меньшей степени печени) с гиперплазией органа, увеличением тока крови в нем, повышением его функционально активности.
Второй механизм обусловлен изменениями физических свойств эритроцитов, снижением их пластичности - способности изменять свою форму при прохожднеии через узкую фильтрационную сеть селезенки. Нарушение пластичности отмечается при мембранных дефектах эритроцитов (наследственный микросфероцитоз), изменении липидного состава мембран (при циррозе печени), аномалиях гемоглобина, ведущих к повышению вязкости внутриклеточной среды эритроцита (серповидно-клеточная анемия), наличии включений в цитоплазме эритроцитов (бета-талассемия, альфа-талассемия), прециптированного гемоглобина в виде телец Гейнца (дефицит глюкозо-6-фосфатдегидрогеназы). Накопление эритроцитов в селезеночной пульпе, независимо от его мхеанизма, вызывает дальнейшую редукцию эритроцитарной поверхности - процесс "кондиционирования", что еще больше ухудшает условия продвижения клеток через синусы селезенки, приводит к необратимой задержке и деструкции эритроцитов путем их фрагментации и фагоцитоза макрофагами.
Наиболее важным признаком в начальной диагностике гемолиза является увеличение числа ретикулоцитов. ретикулоцитоз отражает активацию костномозговой продукции эритроцитов в ответ на их разрушение на периферии. Кроме того, ускоренный выброс из костного мозга недозрелых эритроцитов, содержащих РНК, обуславливает феномен полихроматофилиии эритроцитов в фиксированных окрашенных азур-эозином мазках крови.
Уровень непрямого билирубина в сыворотке крови при гемолизе повышен. Уровень его повышения зависит от активности гемолиза и способности гепатоцитов к образованию прямого билирубина и его экскреции. Уровень прямого билирубина (связанного) в сыворотке крови нормальный и билирубинурия отсутствует, так как через неповрежденный почечный фильтр проходит только прямой билирубин. В моче и кале содержится увеличенное количество уробилина и стеркобилина.
Таким образом, повышенный гемолиз независимо от его этиологии всегда приводит к характерной клинической триаде:
Анемия
Желтуха с лимонным оттенком
Спленомегалия
Несколько практических советов: как запомнить, что прямой билирубин - это связанный, а непрямой - свободный. Быть прямым и свободным одновременно невозможно следовательно прямой билирубин связанный. Не свой. Непрямой билирубин свободный.
19.3
20 Паренхиматозная желтуха обусловлена повреждением гепатоцитов
Причины – острые вирусные инфекции, хронические и токсические гепатиты
Наблюдается снижение функциональных возможностей печени
Нарушается метаболизм билирубина на всех трех этапах
20.2 При паренхиматозной желтухе повышается уровень прямого билирубина. В норме прямой билирубин выделяется в желчный капилляр и далее по билиарному дереву поступает в двенадцатиперстную кишку. Этот путь транспорта может нарушаться на внутриклеточном участке. Таким образом, при паренхиматозной желтухе страдает сама печеночная клетка. Этот вид желтухи возникает, например, при вирусных гепатитах. Вирус гепатита А обладает прямым повреждающим действием на клетки печени. Иммунная реакция в ответ на попадание вируса обычно адекватна, что и обусловливает редкость тяжелых форм заболевания и отсутствие перехода в хронический гепатит. Вирус гепатита В не обладает прямым цитопатогенным действием, но инкорпорирование вирусов или их частиц в мембраны печеночных клеток вызывает развитие клеточной цитотоксической реакции, направленной против клеточной оболочки, которая может приводить к некрозу печеночных клеток. Полный зрелый вирус гепатита В имеет 3 антигенные системы. В наружной оболочке вируса содержится поверхностный антиген (HbsAg), во внутренней оболочке - 2 антигена, HbеAg локализуется в цитоплазме гепатоцита, но не проникает в ядро, HbcAg (от латинского соr - сердцевина, ядро) проникает в ядро гепатоцита. Последний никогда не обнаруживается в крови, где можно выявить лишь антитела к нему. HbsAg способен образовывать с иммунные комплексы, которые могут циркулировать в крови (ЦИКи). Именно наличие циркулирующих иммунных комплексов при хроническом гепатите обусловливает наличие целого ряда системных проявлений. Кроме вирусных гепатитов, печеночные клетки поражаются и при гепатитах другой этиологии (острые токсические, лекарственные гепатиты, алкогольные гепатиты).
21.1 Развивается при нарушении желчеотделения
Причины – желчнокаменная болезнь, опухоль поджелудочной железы др.
Билирубин не поступает в кишечник, хотя гепатоциты продолжают его коньюгировать
При этом виде желтухи также увеличивается уровень прямого билирубина, что обусловлено нарушением оттока желчи по внепеченочным желчным протока. Таким образом, обтурационная желтуха является следствием закупорки желчных протоков. Это патологическое состояние, которое не имеет однородных этиологических факторов. В патогенезе ключевым моментов является нарушение оттока желчи. Желчь не втекает в желудочно-кишечный тракт, следовательно не происходит нормального всасывания и переваривания. Обтурация происходит за счет:
камня
опухоли
рубцовой стриктуры протоков
При опухоли наблюдается ахолия, холемия. При закупорке камней присоединяется инфекция (холангит), что отягощает течение обтурационной желтухи. Наблюдается синдром Шарко или, другое название триада Шарко: желтуха, сопровождающаяся увеличением печени, боли, лихорадка. Это острое состояние, связанное с закупоркой. Застой желчи, закупорка и инфекция являются ведущими моментами. В тяжелых случаях может развиться сепсис, при котором появится пентада Рейнольда: триада Шарко + гипотония и спутанное сознание. Таким образом, речь идет о билиарном септическом шоке. Чаще всего камни вентильные. В крови лейкоцитоз, ускорение СОЭ, сдвиг формулы влево, анемия. В моче - желчные пигменты. Кал не окрашен, но при вентильном камне кал то окрашен, то нет. В биохимическом анализе крови щелочная фосфатаза не увеличена. Паренхиматозных поражений нет. Будут гнойная инфекция и синдром холестаза.
22. Лейкоциты - клетки крови, осуществляющие фагоцитоз
Образуются в костном мозге
В клинической практике лейкоциты делят на:
гранулоциты
агранулоциты
22.2 Моноциты
непродолжительное время циркулируют в кровотоке
попадают в периферические ткани, где трансформируются в тканевые макрофаги
макрофаги более эффективно, чем нейтрофилы, захватывают и поглощают микобактерии, грибки и макромолекулы. Особенности:
крупное ядро, следовательно, интенсивен биосинтез белка
играют важную роль в захвате (фагоцитозе), переработке и представлении (презентации) антигенов лимфоцитам в ходе клеточных и гуморальных иммунных реакций
Гранулоциты: Нейтрофильные, Эозинофильные, Базофильные
Нейтрофилы - самая большая группа циркулирующих лейкоцитов
Продолжительность жизни - 15 дней Особенности:
Нейтрофилы обладают уникальной способностью увеличивать свою численность как за счет увеличения пролиферации, так и за счет «рекрутирования» зрелых клеток из костного мозга
Нейтрофилы мигрируют в очаги инфекции, где распознают, захватывают и уничтожают патогены
Эозинофилы
После созревания циркулируют в кровотоке около 10 часов
затем поступают в ткани
срок их жизни - около 6 суток
наибольшее их количество выявляется в тканях, соприкасающихся с внешней средой (подслизистый слой дыхательного, пищеварительного и частично мочеполового тракта) Особенности:
Эозинофилы имеют большое количество гранул, содержащих основные белки, воспринимающие кислые красители - такие как эозин
Эозинофилы играют особую роль в борьбе с паразитами и контроле аллергии
Гранулы эозинофилов содержат особые группы бел
эозинофильный катионный протеин, обладающий цитотоксичностью, повреждает некоторые личинки гельминтов
Гистаминаза - инактивируют гистамин
Арилсульфатаза - инактивируют гепарин
Фосфолипаза –разрушает фосфолипиды клеточных мембран
Кислая фосфатаза
Коллагеназа
Эластаза
Глюкуронидаза
Эозинофильная пероксидаза
Отличительной чертой от других гранулоцитах является участие в аллергических реакциях, в связи с наличием на мембране рецептора к IgЕ
Базофилы - самая малочисленная группа циркулирующих гранулоцитов Около 6 часов циркулируют в кровотоке, а затем мигрируют в ткани
В тканях (эпителий и соединительная) функционируют тучные клетки, которые, скорее всего, дифференцируются из базофилов
Особенности:
Гранулы базофилов и тучных клеток содержатся БАВ, которые воспринимают щелочные красители (гематоксилин, азур)
Содержимое гранул - гистамин, серотонин, гепарин
22.3-?
23.1 Компоненты свертывающей системы крови
Тромбоциты, факторы свертывающей системы плазмы крови