Цель работы: провести качественный анализ раствора, в котором возможно присутствие ионов  , K+, Na+, Mg2+, Ca2+, Ba2+.
, K+, Na+, Mg2+, Ca2+, Ba2+.
Сущность работы. Согласно сульфидной классификации ионы  , K+, Na+ и Mg2+ относятся к I аналитической группе, а ионы Ca2+ и Ba2+ – ко II аналитической группе.
, K+, Na+ и Mg2+ относятся к I аналитической группе, а ионы Ca2+ и Ba2+ – ко II аналитической группе.
Катионы II группы мешают обнаружению катионов I группы, поэтому их надо предварительно отделить, используя групповой реагент – (NH4)2CO3 в присутствии аммиачного буфера:

В результате выполнения групповой реакции катионы II группы перейдут в осадок в виде карбонатов, а катионы I группы останутся в растворе:
| NH4+, K+, Na+, Mg2+, Ca2+, Ba2+ | ||
| + (NH4)2CO3, NH4OH, NH4Cl, t ° | ||
 
| ||
Раствор:  , K+, Na+, Mg2+ , K+, Na+, Mg2+
| Осадок: CaCO3, BaCO3 |
После разделения на группы проводят анализ раствора и анализ осадка. Осадок необходимо предварительно растворить. Для этого используют уксусную кислоту:
BaCО3¯ + 2СН3СООН ® (СН3СОО)2Ba + CО2 + H2O
СaCО3¯ + 2СН3СООН ® (СН3СОО)2Сa + CО2 + H2O
Ион Ba2+ мешает обнаружению иона Ca2+, поэтому необходимо провести разделение этих ионов внутри группы. Для этих целей используется та же реакция, с помощью которой открывают Ba2+, действуя раствором K2Cr2О7 в присутствии ацетатного буфера (СН3СООН и СН3СООNa):
2Ba2+ + K2Cr2О7 + H2O ® 2BaCrО4¯ + 2K+ + 2H+
В результате ион Ba2+ переходит в осадок в виде хромата, а ион Ca2+ остается в фильтрате, где его и открывают с помощью характерной реакции.
При анализе раствора, содержащего катионы I группы, также необходимо провести разделения внутри группы. Ионы NH4+ мешают обнаружению K+ и Na+, поэтому прежде всего их надо удалить. Удаление проводится путем выпаривания раствора до сухих солей и прокаливания сухого остатка до полного удаления NH4+:
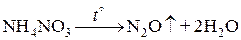
В растворе, полученном после удаления  , находятся K+, Na+ и Mg2+, причем ионы Mg2+ мешают обнаружению ионов Na+. Поэтому проводят их разделение, используя реакцию со щелочью KOH:
, находятся K+, Na+ и Mg2+, причем ионы Mg2+ мешают обнаружению ионов Na+. Поэтому проводят их разделение, используя реакцию со щелочью KOH:
Мg2+ + 2KОН ® Мg(ОН)2¯ + 2K+
В полученном фильтрате открывают ионы Na+.
Для обнаружения отдельных ионов в лабораторной работе используют следующие характерные реакции:
| Ион | Реагент, условия проведения реакции | Аналитическая реакция | Аналитический эффект |
| Катионы I группы | |||
| NH4+ | NaOH (КОН), t °, индикаторная бумага | NH4+ + OH– ® NH3 + + H2O | Посинение индикаторной бумаги |
| реактив Несслера, t ° | NH3 + 2K2[HgI4] + 3KOH ® HN-Hg2IOH¯ + 7KI + + 2H2O | Образование красно-бурого осадка или желтого окрашивания | |
| К+ | Na2PbCu(NO2)6, t ° | 2K+ + Na2PbCu(NO2)6 ® ® K2PbCu(NO2)6 + 2Na+ | Образование черных кубических кристаллов |
| Mg2+ | КОН, t ° | Мg2+ + 2КОН ® ® Мg(ОН)2¯ + 2К+ | Образование белого аморфного осадка |
| Na2HPO4 в присутствии NH4OH и NH4Сl | Mg2+ + HPO42– + NH3 ® ® NH4MgPO4↓ | Образование белого кристаллического осадка | |
| Na+ | KH2SbO4, t ° (микрокристаллоскопическая реакция) | Na+ + KH2SbO4 ® ® NaH2SbO4 + K+ | Образование бесцветных прозрачных кристаллов зернообразной формы |
| KH2SbO4, рН = 7 (пробирочная реакция) | Na+ + KH2SbO4 ® ® NaH2SbO4¯ + K+ | Образование белого кристаллического осадка | |
| Катионы II группы | |||
| Ba2+ | K2Cr2О7 в присутствии СН3СООН и СН3СООNa | 2Ba2+ + K2Cr2О7 + H2O ® ® 2BaCrО4¯ + 2K+ + 2H+ | Образование желтого мелкокристаллического осадка |
| Ca2+ | (NH4)2C2O4, t ° | Са2+ +  ® СаС2О4¯ ® СаС2О4¯
| Образование белого кристаллического осадка |
Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид раствора (окраска, прозрачность). Далее используют отдельные порции исследуемого раствора для проведения предварительных испытаний и систематического хода анализа.