Цель работы: провести качественный анализ раствора, в котором возможно присутствие анионов  ,
,  ,
,  , Cl–, I–,
, Cl–, I–,  ,
,  .
.
Сущность работы. Согласно классификации анионов, основанной на растворимости солей бария и серебра, ионы  ,
,  и
и  относятся к первой, ионы Cl– и I– – ко второй, а ионы
относятся к первой, ионы Cl– и I– – ко второй, а ионы  и
и  – к третьей аналитическим группам.
– к третьей аналитическим группам.
В отличие от катионов, анионы различных групп не мешают открытию друг друга, поэтому анализ предложенной смеси можно выполнить дробным методом, т. е. в отдельных порциях исследуемого раствора, не проводя групповых разделений.
При анализе смеси анионов групповые реагенты чаще всего применяют не для разделения групп, а для того, чтобы установить их наличие или отсутствие в ходе предварительных испытаний. Если установлено отсутствие анионов всей группы, то не следует проводить реакции на отдельные анионы. Таким образом, проведение групповых реакций значительно облегчает работу и экономит время. В работе используются следующие групповые реакции:
| Группа | Групповой реагент, условия | Групповые реакции | Аналитический эффект |
| I | BaCl2 при рН 7–9 | 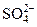 + BaCl2 ® BaSО4¯ + 2Cl– + BaCl2 ® BaSО4¯ + 2Cl–
 + BaCl2 ® BaСО3¯ + 2Cl– + BaCl2 ® BaСО3¯ + 2Cl–
 + 3BaCl2 ® Ba3(РО4)2¯ + + 6Cl– + 3BaCl2 ® Ba3(РО4)2¯ + + 6Cl–
| Образование белых мелкокристаллических осадков |
| II | AgNO3 в 2 н. НNO3 | Cl– + AgNO3 ® AgCl¯ +  I– + AgNO3 ® AgI¯ +
I– + AgNO3 ® AgI¯ + 
| Образование белого творожистого (AgCl) или светло-желтого (AgI) осадка |
При проведении предварительных испытаний на анионы делают также пробу на выделение газов, действуя на раствор 2 н. H2SO4. При этом анионы летучих кислот разлагаются с выделением пузырьков газа. Из анионов, которые могут быть в анализируемом растворе, такой эффект дают только  и
и  :
:
 + 2Н+ ® CO2↑ + Н2О
+ 2Н+ ® CO2↑ + Н2О
 + 2Н+ ® NO2↑ + NO↑ + Н2О
+ 2Н+ ® NO2↑ + NO↑ + Н2О
Анионы I аналитической группы не мешают обнаружению друг друга, а внутри II и III аналитических групп необходимо провести разделение ионов.
Ионы I– мешают открытию ионов Cl–, поэтому их предварительно отделяют, используя селективное растворение осадков галогенидов серебра в NH4OH (конц.). Сначала действуют групповым реагентом AgNO3 в 2 н. НNO3, в результате оба иона переходят в осадок:
Cl– + AgNO3 ® AgCl¯ + 
I– + AgNO3 ® AgI¯ + 
Затем добавляют NH4OH (конц.), в котором осадок AgCl растворяется с образованием аммиаката, а AgI – не растворяется вследствие различия в значениях произведений растворимости (~ 10–10 и ~ 10–17 соответственно):
AgCl↓ + 2NH4OH = [Ag(NH3)2]Сl + 2H2O
Осадок AgI отбрасывают, а в полученном фильтрате открывают ионы Cl–.
Ионы  мешают обнаружению ионов
мешают обнаружению ионов  , поэтому их предварительно необходимо удалить. С этой целью проводят реакцию контрпропорционирования с мочевиной в кислой среде, в результате которой ионы NO2– уходят из раствора в виде газа:
, поэтому их предварительно необходимо удалить. С этой целью проводят реакцию контрпропорционирования с мочевиной в кислой среде, в результате которой ионы NO2– уходят из раствора в виде газа:
 + 2H+ + CO(NH2)2 = CO2↑ + 2N2↑ + 3H2O
+ 2H+ + CO(NH2)2 = CO2↑ + 2N2↑ + 3H2O
При проведении характерных реакций на анионы для доказательства их присутствия часто необходимо не только убедиться в выпадении осадка, но и провести испытание на его растворимость в растворах различных реагентов.
В работе используются следующие характерные реакции:
| Ион | Реагент, условия проведения реакции | Аналитическая реакция | Аналитический эффект |
| Анионы I группы | |||
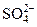
| BaCl2 при рН 7–8, HCl | 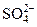 + Ва2+ ® ® ВаSO4¯ + Ва2+ ® ® ВаSO4¯
| Образование белого мелкокристаллического осадка, не растворимого в HCl |

| HCl, Ba(OH)2 |  + Н+ ® CO2↑ + + Н2О
CO2↑ + Ba(OH)2 ® ® BaCO3¯ + Н+ ® CO2↑ + + Н2О
CO2↑ + Ba(OH)2 ® ® BaCO3¯
| Выделение из раствора пузырьков газа и помутнение баритовой воды |
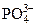
| Mg2+, NH4OH, NH4Cl | 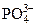 + Mg2+ + NH4+ ® MgNH4PO4¯ + Mg2+ + NH4+ ® MgNH4PO4¯
| Образование белого кристаллического осадка |
| Анионы II группы | |||
| I– | Хлорная вода, H2SO4, бензол | 2I– + Cl2 ® I2 + 2Cl– | Окрашивание бензольного слоя в малиновый цвет |
| Cl– | AgNO3, 2 н. HNO3, 25 %-ный NH4OH, KBr | Cl– + Ag+ ® AgCl↓ AgCl↓ + 2NH4OH ® [Ag(NH3)2]Сl + 2H2O [Ag(NH3)2]Сl + KBr+ + 2HNO3 ® AgBr↓ + KCl +2NH4NO3 | Образование белого творожистого осадка; растворение осадка в NH4OH; появление мути при действии KBr |
| Анионы III группы | |||
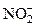
| KI, HCl или CH3COOH, крахмал (пробирочная реакция) |  + 2I– + 4H+ ® I2 + 2NO + 2H2O + 2I– + 4H+ ® I2 + 2NO + 2H2O
| Побурение раствора; появление темно-синей окраски после добавления крахмала |
| KI, HCl или CH3COOH, крахмал (капельная реакция) | Появление синей окраски | ||

| Дифениламин в конц. H2SO4 |  + H+ + + (С6Н5)2NH ® продукт окисления синего цвета + H+ + + (С6Н5)2NH ® продукт окисления синего цвета
| Появление интенсивной синей окраски на стенках пробирки |
Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид раствора (окраска, прозрачность). Далее используют отдельные порции исследуемого раствора для проведения предварительных испытаний и систематического хода анализа.