Цель работы: определить перманганатометрическим методом:
– проба А – массу Fe2+ или соли Мора (NH4)2SO4 ∙ FeSO4·6H2O (г);
– проба Б – окисляемость водопроводной или технологической воды (мг О2/л);
– проба В – массовую долю нитритов в пищевой добавке Е 250 (%).
Сущность работы. Перманганатометрическое титрование применяют преимущественно для определения веществ, играющих по отношению к KMnO4 роль восстановителей, таких, как H2O2, NO2–, Fe2+, карбоновые кислоты, соединения с гидразогруппами R–NH–NH–R, для определения общей окисляемости воды и почвы (т. е. для определения суммы восстановителей, присутствующих в этих объектах).
Для этих целей используют прямое или обратное перманганатометрическое титрование в сильнокислой среде, которую создают добавлением раствора H2SO4. Фиксирование к. т. т. проводят без индикатора, поскольку первая лишняя капля раствора титранта KMnO4, добавленная после точки эквивалентности, окрашивает раствор в розовый цвет.
Определение Fe2+ основано на реакции

Факторы эквивалентности Fe2+ и MnO4– определяются, исходя из полуреакций:
| Fe3+ - е - = Fe2+ | Þ f экв(Fe2+) = 1 |

| Þ f экв(MnO4–) = 
|
Реакция окисления железа(II) перманганатом калия протекает быстро при комнатной температуре. Образующиеся при реакции ионы Fe3+ окрашивают раствор в желтый цвет, поэтому их маскируют, связывая в бесцветные фосфатные комплексы добавлением фосфорной кислоты. За счет этого переход окраски от бесцветной к розовой наблюдается более отчетливо.
Окисляемость воды определяется количеством окислителя (или эквивалентным количеством кислорода), затраченным на окисление примесей. Окисляемость характеризует загрязненность воды органическими компонентами, а также сульфитами, сульфидами, хлоридами, нитритами и выражается массой (мг) кислорода, расходуемого на окисление 1 л воды. Например, окисляемость воды в производстве алкогольных и безалкогольных напитков не должна превышать 3 мг О2/л.
Определение основано на окислении восстановителей, находящихся в воде, перманганатом в кислой среде. Поскольку некоторые из восстановителей окисляются медленно, то применяют «двойное» обратное титрование. В анализируемую воду вводят точно отмеренный избыток стандартного раствора KМnО4, затем – точно отмеренный избыток стандартного раствора щавелевой кислоты, которая взаимодействует с остатком KМnО4. Не вступившую в реакцию щавелевую кислоту титруют раствором перманганата калия и по полученным результатам рассчитывают окисляемость воды:

Определение нитритов основано на реакции
 +
+  + 6H+ =
+ 6H+ = 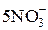 + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O
Поскольку нитриты разлагаются в кислой среде с образованием оксидов азота
 + 2H+ = 2HNO2 = NO↑ + NO2↑ + H2O
+ 2H+ = 2HNO2 = NO↑ + NO2↑ + H2O
то при проведении перманганатометрического титрования в кислой среде изменяют порядок титрования на обратный (реверсивное титрование): стандартный раствор перманганата титруют анализируемым раствором нитрита.
Оборудование и реактивы: бюретка, пипетка Мора, мерная колба, коническая колба, мерный цилиндр (50–100 мл), стандартный раствор KMnO4, 2 н. раствор H2SO4. Для анализа пробы А дополнительно: H3РO4 (конц.) в капельнице. Для анализа пробы В дополнительно: электроплитка.
Для анализа пробы Б: электроплитка, 0,01 моль/л стандартный раствор H2C2O4, 0,01 моль/дм3 стандартный раствор KMnO4, 2 моль/л раствор H2SO4, бюретка, пипетки Мора (10,00 и 100,00 мл), мерная колба (100,0 мл), конические колбы для титрования из термостойкого стекла (250 мл), мерный цилиндр (10 мл), химический стакан (100 мл), часовое стекло, водопроводная или технологическая вода.
Выполнение работы
Проба А. Fe2+ или соль Мора. Получают у лаборантов анализируемый раствор в мерную колбу. К содержимому колбы прибавляют 20–40 мл 2 н. H2SO4, затем доводят объем дистиллированной водой до метки и перемешивают.
Пипеткой берут из мерной колбы аликвотную часть анализируемого раствора и переносят в коническую колбу для титрования. Перед титрованием в раствор вводят 3–4 капли фосфорной кислоты из капельницы. Титруют до появления неисчезающей слабо-розовой окраски, вызываемой одной избыточной каплей раствора KMnO4.
По полученным данным рассчитывают массу Fe2+ илисоли Мора (NH4)2SO4 ∙ FeSO4 ∙ 6H2O в пробе (г).
Проба Б. Водопроводная или технологическая вода. В коническую колбу помещают 100,00 мл анализируемой воды, добавляют 5 мл серной кислоты и 10,00 мл стандартного раствора перманганата калия из бюретки. Закрывают колбу часовым стеклом, нагревают под тягой до кипения и кипятят 10 мин. К горячему раствору добавляют 10,00 мл стандартного раствора щавелевой кислоты, тщательно перемешивают. Обесцветившийся горячий раствор титруют раствором KМnО4 до появления устойчивой бледно-розовой окраски.
Если концентрации стандартных растворов KMnO4 и H2C2O4 равны и для проведения реакций (3) и (4) взяты их одинаковые объемы, то объем раствора KMnO4, который затрачен на титрование по реакции (5), будет равен объему раствора KMnO4, пошедшему на взаимодействие с восстановителями в реакции (3). Следовательно, суммарную молярную концентрацию эквивалента восстановителей в анализируемой воде рассчитывают по формуле

Далее переходят к расчету окисляемости воды, т. е. массовой концентрации О2, мг/л:

Фактор эквивалентности О2 определяется, исходя из полуреакции:

Проба В. Нитриты. Поскольку для анализа предложена сухая смесь соли NaNO2 с индифферентными примесями (пищевая добавка Е 250), то рассчитывают ориентировочную навеску образца, необходимую для приготовления раствора NaNO2 заданной концентрации в имеющейся мерной колбе. Затем берут навеску на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят до метки и перемешивают. Полученным раствором заполняют бюретку.
В коническую колбу для титрования вместимостью 250 мл переносят пипеткой аликвотную часть стандартного раствора перманганата калия, добавляют 10 мл 2 н. раствора H2SO4 и 100 мл дистиллированной воды. Слегка нагрев разбавленный раствор перманганата калия, титруют его раствором нитрита натрия до обесцвечивания розовой окраски раствора от одной капли титранта.
По результатам титрования рассчитывают массовую долю NaNO2 в образце (%).
| & | М (Fe2+) = 55,847 г/моль М [(NH4)2SO4 · FeSO4 · 6H2O] = 392,14 г/моль | М (О2) = 31,9988 г/моль М (NaNO2) = 68,9953 г/моль |
| : | С использованием ПО «Практикум по АХ и ФХМА »: – оценить неопределенность измерений; – провести Q -тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений. |